题目内容
12.将一种无色的液体A装入试管,用带火星的木条试验,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C瓶底有少量液体D的集气瓶中,金属E剧烈燃烧,火星四射,生成黑色固体F.将黄色粉末G放入气体C中点燃,生成有刺激性气味的气体H.(1)写出以下物质的化学式:AH2O2;BMnO2;EFe;FFe3O4;HSO2.
(2)写出金属E在C中燃烧的文字表达式式:铁+氧气$\stackrel{点燃}{→}$四氧化三铁,反应的基本类型是化合反应.
分析 根据C“使带火星的木条复燃”,故C为氧气,“无色无味的液体”A中加入少量“黑色粉末”B后,迅速产生氧气,根据氧气的制法可知A为双氧水,B为二氧化锰;金属E在氧气中“剧烈燃烧,火星四射,生成黑色固体”F,则E为铁,F为四氧化三铁;为防止铁丝燃烧时溅落的熔化物炸裂瓶底,集气瓶底要盛少量水,故D为水;“黄色粉末”G能够在氧气中燃烧“生成刺激性气味”H,则G为硫,据此分析解答即可.
解答 解:(1)根据C“使带火星的木条复燃”,故C为氧气,“无色无味的液体”A中加入少量“黑色粉末”B后,迅速产生氧气,根据氧气的制法可知A为双氧水,B为二氧化锰;金属E在氧气中“剧烈燃烧,火星四射,生成黑色固体”F,则E为铁,F为四氧化三铁;为防止铁丝燃烧时溅落的熔化物炸裂瓶底,集气瓶底要盛少量水,故D为水;“黄色粉末”G能够在氧气中燃烧“生成刺激性气味”H,则G为硫,H是二氧化硫;
(2)铁丝与氧气反应的文字表达式为铁+氧气$\stackrel{点燃}{→}$四氧化三铁;该反应属于“多变一”的化合反应;
故答案为:
(1)A.H2O2; B.MnO2; E.Fe; F. Fe3O4; H.SO2;
(2)铁+氧气$\stackrel{点燃}{→}$四氧化三铁;化合反应.
点评 本题属于常见物质的推断题,解题关键是根据物质的物理性质或明显的化学反应特征,找准解题的突破口,并从突破口出发结合物质间的关系得出结论,带入验证符合要求即可.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
14.括号内是区别下列各组常见物质的试剂方法,其中错误的是( )
| A. | 硬水与软水 (肥皂水,振荡) | |
| B. | 水与双氧水 (加入少量二氧化锰粉末) | |
| C. | 二氧化碳与氮气 (燃着的木条) | |
| D. | 食盐水与蒸馏水 (蒸发) |
15.下列化学方程式书写正确的是( )
| A. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | ||
| C. | C+2CuO═2Cu+CO2 | D. | Ca(OH)2+H2SO4═CaSO4+H2O |
1.如图是稀盐酸与NaOH溶液恰好完全反应的微观示意图,由此得到的结论不正确的是( )
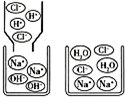

| A. | 稀盐酸中存在的粒子是H+、Cl-和H20 | |
| B. | 反应结束时溶液的pH=7 | |
| C. | 该反应的实质是H+和OH-结合生成H20分子 | |
| D. | 若两者恰好完全反应,所得溶液中溶质的质量分数为35.1%,则此溶液中钠离子与水分子的个数比为351:649 |
 化学实验小组的同学们把盐酸和石灰石放入气密性良好的图装置中,
化学实验小组的同学们把盐酸和石灰石放入气密性良好的图装置中,