题目内容
12.海水是种宝贵资源.用途一:提供海上航行饮用水.一般可采用图1装置获得淡水.用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为500g.

用途二:“海水晒盐”.地球上总储水量很大,但淡水很少,海水中溶解了很多物质,又苦又咸,除了含H2O外,还含有NaCl、CaSO4、MgSO4等.以海水为原料提取食盐的工艺流程如图2:
(1)图中①是蒸发池(填“蒸发”或“冷却”).
(2)“母液”的成分中,大量含有的阳离子是Ca2+、Mg2+、Na+(填离子符号).
(3)根据海水晒盐的原理,下列说法中不正确的是AC.
A.得到的粗盐是纯净的氯化钠
B.在①中,海水中水的质量逐渐减少
C.在①中,海水中氯化钠的质量逐渐增加
D.海水进入储水池,海水的成分基本不变.
分析 用途一:溶液稀释前后,溶质质量不变;
用途二:蒸发海水时,随着水的蒸发,氯化钠质量分数越来越大,当达到饱和状态时,继续蒸发时会析出氯化钠固体;
“母液”的成分中,大量含有的阳离子有钙离子、镁离子和钠离子;
A.得到的粗盐中含有泥沙等物质,因此粗盐属于混合物;
B.在①中,随着水的蒸发,海水中水的质量逐渐减少;
C.在①中,一段时间内,海水中氯化钠的质量不变,当达到饱和状态时,继续蒸发时会析出氯化钠固体,海水中的氯化钠质量逐渐减小;
D.海水进入储水池,海水的成分基本不变.
解答 解:用途一:设蒸发水的质量为x,
根据题意有:2000g×3%=(2000g-x)×4%,
x=500g,
则收集到的可饮用水为500g.
故填:500.
用途二:(1)图中①是蒸发池.
故填:蒸发.
(2)“母液”的成分中,大量含有的阳离子是Ca2+、Mg2+、Na+.
故填:Ca2+、Mg2+、Na+.
(3)A.得到的粗盐中含有泥沙等物质,因此粗盐属于混合物,该选项说法不正确;
B.在①中,随着水的蒸发,海水中水的质量逐渐减少,该选项说法正确;
C.在①中,一段时间内,海水中氯化钠的质量不变,当达到饱和状态时,继续蒸发时会析出氯化钠固体,海水中的氯化钠质量逐渐减小,该选项说法不正确;
D.海水进入储水池,海水的成分基本不变,该选项说法正确.
故填:AC.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.八年级(二)班同学计算30克炭完全燃烧可以得到多少克二氧化碳时,出现了以下几种算式,其中正确的是 ( )
| A. | $\frac{12}{30克}$=$\frac{x}{44}$ | B. | $\frac{12}{44}$=$\frac{30克}{x}$ | C. | $\frac{12}{x}$=$\frac{30克}{44}$ | D. | $\frac{12}{x}$=$\frac{44}{30克}$ |
4. 甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
 甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )| A. | t1℃甲、乙的饱和溶液,降低温度,甲先析出晶体 | |
| B. | t1℃时,70g甲的饱和溶液加入40g乙物质,溶液质量仍为70g | |
| C. | 将t2℃甲、乙的饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 | |
| D. | 将t2℃等质量的甲、乙饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 |
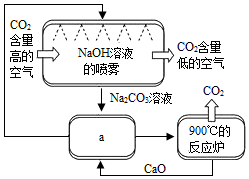 空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.
空气中CO2浓度的持续走高引起人们的高度重视.一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉”CO2的方法.一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示.


