题目内容
17. 甲、乙、丙三种固体物质的溶解度曲线如图所示.
甲、乙、丙三种固体物质的溶解度曲线如图所示.(1)甲在t2℃时的溶解度为25g;
(2)t1℃时30g丙与50g水充分溶解形成饱和(填“饱和”或“不饱和”)溶液;
(3)甲的饱和溶液中含有少量的乙可以采用降温结晶(或冷却热饱和溶液) 提纯甲.
(4)下列说法错误的是AC(填序号).
A.从t3℃甲、乙、丙的饱和溶液降温到t2℃时,析出晶体最多的是甲
B.将t2℃50g丙的饱和溶液加水稀释成溶质质量分数为10%的丙溶液,需要用到的仪器有:烧杯、玻璃棒、量筒(50ml)、胶头滴管
C.t2℃乙的饱和溶液中加入固体甲,乙的溶质的质量分数不变
D.t3℃等质量甲、乙、丙的饱和溶液中,含溶剂最多的是丙
E.将接近饱和的甲溶液变成甲的饱和溶液,溶质质量分数可能不变.
分析 (1)根据题目信息和溶解度曲线可知:甲在t2℃时的溶解度为25g;
(2)t1℃时,丙的溶解度是50g,因此30g丙与50g水充分溶解形成75g饱和溶液;
(3)甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化较大,乙变化不大,所以甲的饱和溶液中含有少量的乙可以采用降温结晶的方法提纯甲;
(4)A、从t3℃甲、乙、丙的饱和溶液降温到t2℃时,析出晶体最多的是甲不正确,因为没有指明是等质量的饱和溶液;
B、将t2℃时,50g丙的饱和溶液加水稀释成溶质质量分数为10%的丙溶液,是溶液由浓变稀,需要用到的仪器有:烧杯、玻璃棒、量筒(50ml)、胶头滴管;
C、t2℃乙的饱和溶液中加入固体甲,乙的溶质的质量分数变小,不变是错误的;
D、t3℃等质量甲、乙、丙的饱和溶液中,含溶剂最多的是丙正确,因为在该温度下,丙的溶解度最小;
E、将接近饱和的甲溶液变成甲的饱和溶液,溶质质量分数可能不变正确,如降低温度.
解答 解:(1)由溶解度曲线可知:甲在t2℃时的溶解度为25g;
(2)t1℃时,丙的溶解度是50g,即100g水中最多溶解50g的丙,因此30g丙与50g水充分溶解形成75g饱和溶液,不能完全溶解;
(3)甲的饱和溶液中含有少量的乙可以采用降温结晶或冷却热饱和溶液的方法提纯甲,因为甲的溶解度受温度的影响变化比乙大;
(4)A、从t3℃甲、乙、丙的饱和溶液降温到t2℃时,析出晶体最多的是甲不正确,因为没有指明是等质量的饱和溶液,不知降温前溶液的质量;
B、将t2℃时,50g丙的饱和溶液加水稀释成溶质质量分数为10%的丙溶液,是溶液由浓变稀,需要用到的仪器有:烧杯、玻璃棒、量筒(50ml)、胶头滴管;
C、t2℃乙的饱和溶液中加入固体甲,甲可溶解,所以溶液的质量增加,而乙的质量不变,故乙的溶质的质量分数变小,不变是错误的;
D、t3℃等质量甲、乙、丙的饱和溶液中,含溶剂最多的是丙正确,因为在该温度下,丙的溶解度最小;
E、将接近饱和的甲溶液变成甲的饱和溶液,溶质质量分数可能不变正确,如降低温度至恰好饱和;
故答案为:(1)25g;(2)饱和;(3)降温结晶(或冷却热饱和溶液);(4)AC.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的状态判断和结晶的方法等,能较好考查学生对知识的掌握和应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案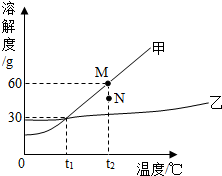 如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )
如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )| A. | 甲的溶解度受温度变化影响比乙大 | |
| B. | t1℃时,甲、乙两物质饱和溶液中溶质的质量分数相同 | |
| C. | 要使组成在N点的甲溶液转变为M点的甲溶液,可以采用升高温度的方法 | |
| D. | 乙采用蒸发溶剂的方法得到乙晶体 |
| A. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Fe+CuSO4=FeSO4+Cu | D. | CH4+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O |
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 苛性钠 | D. | 铝丝 |

| A. | 该反应过程中元素的种类不变 | B. | 该反应过程中分子的种类不变 | ||
| C. | 在化学变化中原子是最小的粒子 | D. | 氢分子能保持氢气的化学性质 |
| A. | 氨气(NH3)中氮元素的化合价为+3 | |
| B. | 金刚石、石墨是碳的单质,而C60则是碳的化合物 | |
| C. | 一个过氧化氢分子是由两个氢原子和两个氧原子构成的 | |
| D. | 由同一种元素组成的物质一定是单质,不可能是化合物 |

