题目内容
3.相对原子质量:H-1 Na-23 O-16 CI-35.5 C:12侯德榜是我国著名的化学家,由他发明的侯氏制碱法制得的纯碱中可能含有少量杂质氯化钠,现取仅含氯化钠杂质的纯碱样品33.2g,加入146g溶质的质量分数为20%稀盐酸中,恰好完全反应.求:
(1)反应生成的气体的质量;
(2)该纯碱样品中Na2CO3的质量;
(3)反应后所得溶液中溶质的质量分数.
分析 纯碱中碳酸钠与稀盐酸反应放出二氧化碳,根据HCl的质量,根据反应的化学方程式,计算出二氧化碳、纯碱中碳酸钠的质量和反应后溶液中溶质氯化钠的质量,从而计算出反应后所得溶液中溶质的质量分数.
解答 解:(1)设参加反应的Na2CO3质量为x,生成的NaCl的质量为y,生成二氧化碳的质量为z.
由题意得HCl的质量为146g×20%=29.2g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 29.2g y 13.2g
$\frac{106}{x}$=$\frac{117}{y}$=$\frac{44}{z}$=$\frac{73}{29.2g}$
解之得 x=42.4g,y=46.8g,z=17.6g
纯碱样品中NaCl的质量=43.2g-42.4g=0.8g
反应后溶液中NaCl的质量为=46.8g+0.8g=36.5g
反应后溶液中NaCl的质量分数=$\frac{46.8g+0.8g}{43.2g+146g-17.6g}$×100%=27.7%
故答案为:(1)反应生成的气体的质量为17.6g
(2)该纯碱样品中Na2CO3的质量42.4gg;
(2)所得溶液中溶质的质量分数为27.7%
点评 反应后所得溶液中溶质氯化钠由原粉末中所含的氯化钠与反应后生成的氯化钠两部分所组成,解题时要注意到这点.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
13.我国高铁设计时速为685km/h,5月18日从长沙下线,其核心技术有一种超导材料,化学式为Y2BaCu6O10,其中Ba、Cu的化合价均为+2价,则Y的化合价是( )
| A. | +5 | B. | +3 | C. | +1 | D. | -3 |
18.某品牌饼干中含有钠、钙、铁、锌、钾、碘等人体所需元素,其中属于微量元素的是( )
| A. | 钙 | B. | 锌 | C. | 钠 | D. | 氧 |
8.下列是实验室配制一定质量分数的氯化钠溶液的操作,其中肯定错误的是( )
| A. |  取用氯化钠 | B. |  称取氯化钠 | C. |  量取水 | D. |  溶解氯化钠 |
12.除去下列物质中的少量杂质,所选试剂及操作都正确的是( )
| 序号 | 物质 | 杂质 | 试剂 | 操作 |
| A | Fe | Fe2O3 | 盐酸 | 结晶 |
| B | NH4HCO3 | NaCl | - | 加热 |
| C | Cu(NO3)2溶液 | BaCl2 | AgNO3溶液 | 过滤 |
| D | O2 | 水蒸气 | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
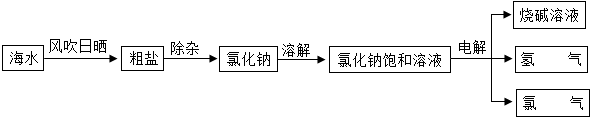
 海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.
海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.