题目内容
14.完成下列变化的化学方程式,并按要求填空.(1)赤铁矿炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应前后气体的化学计量数之比是1:1.
(2)生石灰作为干燥剂的原理CaO+H2O═Ca(OH)2,该反应属于放热反应(填“放”或“吸”).
(3)氨水与硫酸反应2NH3•H2O+H2SO4═(NH4)2SO4+2H2O,基本反应类型是复分解反应.
(4)分别将铜片和锌片连接到电流表的正、负极,然后把锌片和铜片一起插入盛有硫酸铜溶液的烧杯中,发生的反应是Zn+CuSO4═ZnSO4+Cu,连接电流表正极的是铜片(填“锌”或“铜”).
(5)酒精(C2H6O)完全燃烧C2H6O+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O,酒精的某种水溶液中溶质和溶剂的氢原子个数相等,则该溶液中溶质的质量分数为46%.
分析 赤铁矿的主要成分是氧化铁,高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
生石灰是氧化钙的俗称,能和水反应生成氢氧化钙,碳酸放出大量的热;
氨水和稀硫酸反应生成硫酸铵和水;
锌和硫酸铜反应生成硫酸锌和铜;
酒精燃烧生成水和二氧化碳.
解答 解:(1)赤铁矿炼铁过程中发生反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应前后气体的化学计量数之比是1:1.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;1:1.
(2)生石灰作为干燥剂的原理是:CaO+H2O═Ca(OH)2,该反应属于放热反应.
故填:CaO+H2O═Ca(OH)2;放.
(3)氨水与硫酸反应的化学方程式为:2NH3•H2O+H2SO4═(NH4)2SO4+2H2O,属于复分解反应.
故填:2NH3•H2O+H2SO4═(NH4)2SO4+2H2O;复分解.
(4)发生的反应是锌和硫酸铜反应,反应的化学方程式为:Zn+CuSO4═ZnSO4+Cu,连接电流表正极的是铜片.
故填:Zn+CuSO4═ZnSO4+Cu;铜.
(5)酒精(C2H6O)完全燃烧的化学方程式为:C2H6O+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;
酒精的某种水溶液中溶质和溶剂的氢原子个数相等,则该溶液中溶质的质量分数为:$\frac{46}{46+54}$×100%=46%.
故填:C2H6O+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;46%.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

 实验课上,甲同学用石蕊试液测定稀盐酸和NaOH溶液的酸碱性,乙同学用石蕊试液测定石灰水和Na2CO3溶液的酸碱性(如图所示).实验后进行废液处理:甲同学将两支试管中的液体倒入烧杯A中,得到蓝色溶液;乙同学将两支试管中的液体倒入烧杯B中,得到蓝色溶液和白色沉淀;最终将A中的溶液和B中的上层清液倒入烧杯C中.
实验课上,甲同学用石蕊试液测定稀盐酸和NaOH溶液的酸碱性,乙同学用石蕊试液测定石灰水和Na2CO3溶液的酸碱性(如图所示).实验后进行废液处理:甲同学将两支试管中的液体倒入烧杯A中,得到蓝色溶液;乙同学将两支试管中的液体倒入烧杯B中,得到蓝色溶液和白色沉淀;最终将A中的溶液和B中的上层清液倒入烧杯C中.(1)甲同学的实验中向稀盐酸中滴加石蕊试液后,溶液颜色为红色.
(2)甲同学将两支试管中的液体混合后,烧杯A溶液中的溶质有BC.
A.HClB.NaOHC.NaCl
(3)两位同学继续对烧杯C中的废液成分进行探究:
【猜想与假设】通过分析上述实验现象,烧杯C中的废液除石蕊和水外,其组成可能为:
①NaCl和NaOH,②NaOH、NaCl、Na2CO3,③NaOH、NaCl、Ca(OH)2.
【设计完成实验】请设计实验验证烧杯C中的废液可能的组成:
| 操作方法 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,向其中滴加足量的稀盐酸 ②取少量滤液于试管中,向其中加入碳酸钠溶液 ③取两只试管,分别加入少量的滤液,分别滴加足量的稀盐酸和碳酸钠溶液 | 有气泡产生 有沉淀产生 以上两只试管均无现象 | 则C中的废液成分是NaOH、NaCl、Na2CO3 则C中的废液成分是NaOH、NaCl、Ca(OH)2 则C中的废液成分是NaOH、NaCl |
| A. | 单质 | B. | 化合物 | C. | 元素 | D. | 原子 |
| A. | 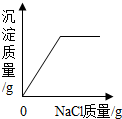 在一定量的AgNO3溶液中逐滴加入NaCl溶液 在一定量的AgNO3溶液中逐滴加入NaCl溶液 | |
| B. | 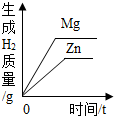 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 | |
| C. |  向NaOH溶液中逐滴加入稀盐酸 向NaOH溶液中逐滴加入稀盐酸 | |
| D. |  向NaOH和Na2CO3的混合溶液中,逐滴加入稀盐酸 向NaOH和Na2CO3的混合溶液中,逐滴加入稀盐酸 |






 江西不仅山清水秀、景色迷人,特色美食更是遍布各地令各路“吃货”流连忘返.
江西不仅山清水秀、景色迷人,特色美食更是遍布各地令各路“吃货”流连忘返.