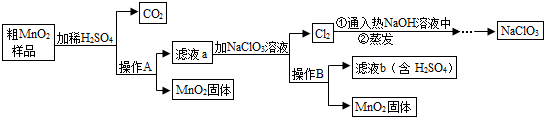
题目内容
2.市场上有许多便宜的“黄金”饰品出售,实际上它们不是黄金,而是铜锌合金,因其具有较好的机械性能和光泽度,所以常被做成饰品,现取20g该合金样品,投入到150g某浓度的稀硫酸中,恰好完全反应,测得剩余物的总质量为169.6g.计算:(1)产生氢气的质量为0.4g
(2)反应后溶液中溶质的质量分数是多少?(计算结果保留到0.1%)
分析 (1)根据质量守恒定律可求出生成的氢气的质量;
(2)根据锌与硫酸反应的方程式,由氢气的质量求出硫酸锌的质量,再结合质量守恒定律及溶质质量分数的计算公式求出剩余溶液中溶质的质量分数.
解答 解:(1)由质量守恒定律可知生成的氢气的质量为:20g+150g-169.6g=0.4g
(2)设参加反应的锌的质量为x,生成的硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
$\frac{65}{x}=\frac{161}{y}=\frac{2}{0.4g}$
解得:x=13g y=32.2g
反应后溶液中溶质的质量分数是$\frac{32.2g}{13g+150g-0.4g}$×100%≈19.8%
故答案为:(1)0.4;(2)反应后溶液中溶质的质量分数是19.8%.
点评 本题难度不大,掌握根据化学方程式的计算的有关要求并结合质量守恒定律的应用即可正确解答本题.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
10. 如图所示,在广口瓶中加入一定时的固体,将胶头滴管中的液体滴加到广口瓶中,能使a端液面明显上升的固体和液体的组合是( )
如图所示,在广口瓶中加入一定时的固体,将胶头滴管中的液体滴加到广口瓶中,能使a端液面明显上升的固体和液体的组合是( )
 如图所示,在广口瓶中加入一定时的固体,将胶头滴管中的液体滴加到广口瓶中,能使a端液面明显上升的固体和液体的组合是( )
如图所示,在广口瓶中加入一定时的固体,将胶头滴管中的液体滴加到广口瓶中,能使a端液面明显上升的固体和液体的组合是( )| A. | 碳酸钠和稀硫酸 | B. | 硝酸铵和水 | C. | 生石灰和水 | D. | 镁条和稀盐酸 |
7.下列物质的用途是由其化学性质决定的是( )
| A. | 干冰做制冷剂 | B. | 石墨做电极 | ||
| C. | 铁制成铁锅 | D. | 氮气用于食品防腐 |
11. 根据如图的信息判断,下列说法正确的是( )
根据如图的信息判断,下列说法正确的是( )
 根据如图的信息判断,下列说法正确的是( )
根据如图的信息判断,下列说法正确的是( )| A. | 硫属于金属元素 | |
| B. | 硫元素的核电荷数为16 | |
| C. | 硫元素的相对原子质量为32.07g | |
| D. | 在化学反应中,硫原子容易失去电子 |