题目内容
1.石灰石在生产生活中有广泛的用途.(1)煅烧石灰石可制得活性CaO,反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
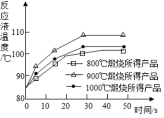
(2)为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃,900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图所示,可知:CaO与水反应会放出热量(填“放出”或“吸收”);上述温度中,900℃煅烧所得CaO活性最高,要得出正确结论,煅烧时还需控制的条件是煅烧的时间
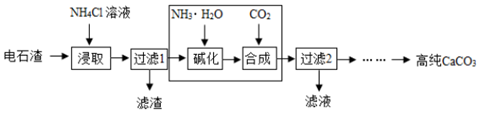
(3)以电石渣(主要成分为Ca(OH)2,还含有少量MgO的杂质)为原料制备高纯CaCO3的流程如下:
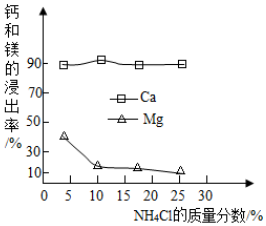
①如图为NH4Cl浓度对钙、镁浸出率的影响(浸出率=进入溶液的某元素的质量/原固体中该元素的总质量×100%),可知:较适宜的NH4Cl溶液的质量分数为10%,浸取时主要反应的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑.
②流程中方框内部分若改用NH4HCO3溶液(填化学式),可一步得到与原流程完全相同的生成物.
③流程中方框内若改用Na2CO3溶液,也能得到高纯CaCO3,试从生成物的角度分析原流程的优点:
a.NH3可循环利用; b.NH4Cl可以循环使用.
分析 (1)根据碳酸钙在高温的条件下生成氧化钙和二氧化碳进行分析;
(2)根据氧化钙和水反应生成氢氧化钙,放出热量,依据图中的数据分析氧化钙的活性,和控制变量法的正确操作方法进行分析;
(3)①根据图象中氯化铵浸出钙离子的质量分数进行分析;
②根据图中的流程分析可知,碳酸氢铵和氨水、二氧化碳所起的作用是相同的进行分析;
③根据反应流程中各物质的反应进行分析.
解答 解:(1)碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)氧化钙和水反应生成氢氧化钙,放出热量,通过分析表中的数据可知,900℃时所得CaO活性最高,要得出正确结论,煅烧时还需控制的条件是煅烧时的时间;
(3)①通过分析图象中氯化铵浸出钙离子的质量分数可知,较适宜的NH4Cl溶液的质量分数为10%,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,所以浸取时主要反应的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
②图中的流程分析可知,碳酸氢铵和氨水、二氧化碳所起的作用是相同的,所以流程中虚线内部分若改用NH4HCO3溶液;
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,除了氨气可以循环使用,NH4Cl可以循环使用.
故答案为:(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)放出,900,煅烧时的时间;
(3)①10%,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
②NH4HCO3;
③NH4Cl可以循环使用.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
11.根据所学化学知识,下列做法不正确的是( )
| A. | 天然气泄漏时,应立刻打开排风扇向外抽气 | |
| B. | 填写档案时,应用碳素墨水 | |
| C. | 不宜用钢丝球洗刷铝制炊具 | |
| D. | 干冰做制冷剂可用于保存食品 |
9.下列图象分别与选项中的实验过程相对应,其中正确的是( )
| A. |  向部分变质的氢氧化钠溶液中滴加稀盐酸 向部分变质的氢氧化钠溶液中滴加稀盐酸 | |
| B. | 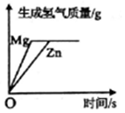 相同质量的镁、锌分别与足量的溶质质量分数相同的稀盐酸反应 相同质量的镁、锌分别与足量的溶质质量分数相同的稀盐酸反应 | |
| C. | 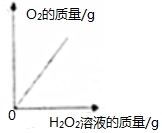 向二氧化锰中加入一定质量的过氧化氢溶液 向二氧化锰中加入一定质量的过氧化氢溶液 | |
| D. | 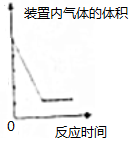 测定空气中氧气的含量 测定空气中氧气的含量 |
16.现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验:
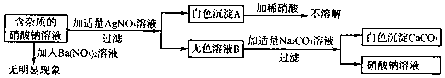
下列判断正确的是( )

下列判断正确的是( )
| A. | 无色溶液B的溶质是硝酸钙 | |
| B. | 原溶液中的杂质只有氯化钙 | |
| C. | 原溶液中的杂质只有硝酸钙和氯化钠二种物质组成 | |
| D. | 该实验中涉及的基本反应类型只有一种 |
6.分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是( )
| A. | H2O、AgNO3、HNO3 | B. | H2O、NaOH、HNO3 | C. | H2O、NaOH、HCl | D. | H2O、KOH、HNO3 |
13.不能反映相关实验过程中量的变化的图象是( )
| A. | 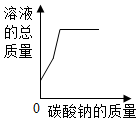 向稀盐酸中加入碳酸钠粉末 | |
| B. | 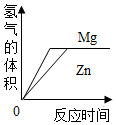 等质量足量的镁、锌分别和等质量等浓度的盐酸反应 | |
| C. | 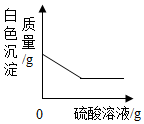 在碳酸钡中不断滴加硫酸溶液 | |
| D. | 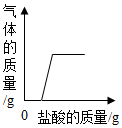 向氢氧化钠溶液中滴加盐酸,利用图象可知氢氧化钠已部分变质 |
 材料的应用和发展与人类文明、进步紧密相关,在日常生活中已得到越来越广泛的应用.
材料的应用和发展与人类文明、进步紧密相关,在日常生活中已得到越来越广泛的应用.
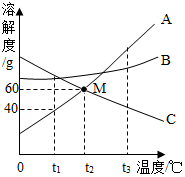 如图是常见固体物质饿溶解度曲线,请根据图示回答问题:
如图是常见固体物质饿溶解度曲线,请根据图示回答问题: