题目内容
16.现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验: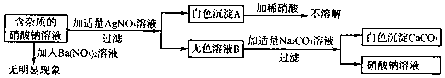
下列判断正确的是( )
| A. | 无色溶液B的溶质是硝酸钙 | |
| B. | 原溶液中的杂质只有氯化钙 | |
| C. | 原溶液中的杂质只有硝酸钙和氯化钠二种物质组成 | |
| D. | 该实验中涉及的基本反应类型只有一种 |
分析 氯化钙不能和硝酸钡反应,能和硝酸银反应生成氯化银沉淀和硝酸钙,硝酸钙能和碳酸钠反应生成碳酸钙沉淀和硝酸钠.
解答 解:A、氯化钙不能和硝酸钡反应,能和硝酸银反应生成氯化银沉淀和硝酸钙,硝酸钙能和碳酸钠反应生成碳酸钙沉淀和硝酸钠,因此硝酸钠中含有氯化钙,氯化钙和硝酸银反应生成氯化银和硝酸钙,因此无色溶液B的溶质是硝酸钙和硝酸钠,该选项说法不正确;
B、原溶液中的杂质可以只含有氯化钙,也可以含有氯化钙和硝酸钙,无论是那种组合,实验现象是相同的,该选项说法不正确;
C、原溶液中的杂质可以是硝酸钙和氯化钠二种物质组成,也可以是硝酸钙、氯化钙和氯化钠三种物质,该选项说法不正确;
D、该实验中涉及的基本反应类型只有一种,即复分解反应,这是因为反应过程中,都是两种化合物相互交换成分生成两种相等化合物,该选项说法正确.
故选:D.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
5.已知粉末X样品是下列四种物质中的一种,取三等分该粉末,分别加入足量的氢氧化钠溶液、氯化钡溶液、稀盐酸充分反应,产生的现象如表.则该固体粉末X是( )
| 加入物质 | 氢氧化钠溶液 | 氯化钡溶液 | 稀盐酸 |
| 现 象 | 固体溶解,产生无色气体 | 产生白色沉淀 | 固体溶解,无气体产生 |
| A. | Mg | B. | K2CO3 | C. | (NH4)2SO4 | D. | (NH4)2CO3 |
11.浩瀚大海给我们提供很多资源,海水中含有大量氯化钠,工业上可以用氯化钠原料来制取碳酸钠、氢氧化钠、氯气和盐酸等.
(1)氢氧化钠溶液和碳酸钠溶液都能使酚酞变红色,它们的溶液pH>(填“<”、“=”或“>”)7.写出碳酸钠与石灰乳反应制备烧碱的化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(2)试管中内壁残留下列物质,用盐酸浸泡能除去的是ACD.
A.铁锈锈渍 B.用碳粉还原氧化铜附着的红色固体
C.长时间盛放石灰水留下的白色固体 D.氢氧化钠和硫酸铜反应后的留下的蓝色固体
(3)工业上把浓海水除钙后,再加入碱性沉淀剂可以制备氢氧化镁.若海水中钙离子含量太高,氢氧化钙会存在于氢氧化镁颗粒中,从而影响氢氧化镁的纯净度.
某研究小组在控制反应温度是20~25℃和浓海水质量为1109g不变的条件下,进行下述对比实验,数据如下:
①进行实验a和b的目的是探究相同条件下,碳酸钠加入量对钙除去率的影响.
②搅拌速率越快,反应时间越长则消耗能源越多.为了节约能源,获得较高的钙除去率,进一步优化“搅拌速率”和“反应时间”的反应条件.在其他实验条件不变情况下,设计对比实验,你应选择的反应条件是AC(填选项).
A.200r/min,3.5h B.200r/min,4.5h C.175r/min,4h D.225r/min,4h.
(1)氢氧化钠溶液和碳酸钠溶液都能使酚酞变红色,它们的溶液pH>(填“<”、“=”或“>”)7.写出碳酸钠与石灰乳反应制备烧碱的化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(2)试管中内壁残留下列物质,用盐酸浸泡能除去的是ACD.
A.铁锈锈渍 B.用碳粉还原氧化铜附着的红色固体
C.长时间盛放石灰水留下的白色固体 D.氢氧化钠和硫酸铜反应后的留下的蓝色固体
(3)工业上把浓海水除钙后,再加入碱性沉淀剂可以制备氢氧化镁.若海水中钙离子含量太高,氢氧化钙会存在于氢氧化镁颗粒中,从而影响氢氧化镁的纯净度.
某研究小组在控制反应温度是20~25℃和浓海水质量为1109g不变的条件下,进行下述对比实验,数据如下:
| 实验 | 碳酸钠加入量/g | 搅拌速度r/min | 反应时间/h | 钙除去率/% |
| a | 1.78 | 200 | 3 | 44.8 |
| b | 2.32 | 200 | 3 | 60.2 |
| c | 2.32 | 125 | 4 | 55.1 |
| d | 2.32 | 200 | 4 | 64.6 |
②搅拌速率越快,反应时间越长则消耗能源越多.为了节约能源,获得较高的钙除去率,进一步优化“搅拌速率”和“反应时间”的反应条件.在其他实验条件不变情况下,设计对比实验,你应选择的反应条件是AC(填选项).
A.200r/min,3.5h B.200r/min,4.5h C.175r/min,4h D.225r/min,4h.
8. 将某氢氧化钠溶液逐滴滴入盐酸和氯化铁的混合溶液中,直至过量.根据空验事实绘制如图所示曲线.其中说法正确的是( )
将某氢氧化钠溶液逐滴滴入盐酸和氯化铁的混合溶液中,直至过量.根据空验事实绘制如图所示曲线.其中说法正确的是( )
 将某氢氧化钠溶液逐滴滴入盐酸和氯化铁的混合溶液中,直至过量.根据空验事实绘制如图所示曲线.其中说法正确的是( )
将某氢氧化钠溶液逐滴滴入盐酸和氯化铁的混合溶液中,直至过量.根据空验事实绘制如图所示曲线.其中说法正确的是( )| A. | ab段红褐色沉淀质量增加 | B. | bc段氯化钠质量不断减少 | ||
| C. | cd段溶液的pH不断减小 | D. | b点所含溶质种类比c点多 |
6.下列有关水的叙述中,正确的是( )
| A. | 用明矾溶液可以区分硬水和软水 | |
| B. | 净水操作中,相对净水程度最高的是蒸馏 | |
| C. | 加活性炭吸附的净水方式可以降低水的硬度 | |
| D. | 通过过滤的方法可以将水中所有杂质与水分离开来 |
 分类是学习化学常用的方法.
分类是学习化学常用的方法.

