题目内容
12.某处工业废水,其中含有大量的氯化亚铁,少量的铜离子以及污泥.设计了一个既经济又合理的方法回收铜和氯化亚铁晶体.方案流程如图: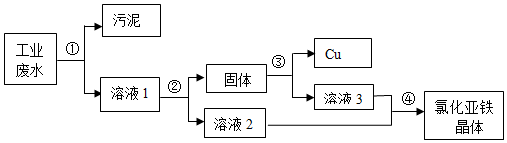
回答下列问题:
(1)步骤②中:需加入的物质是铁,分离所得混合物的方法是过滤;发生反应的化学方程式是Fe+CuSO4=FeSO4+Cu.
(2)步骤③中:需加入的物质是稀硫酸,发生反应的化学方程式是Fe+H2SO4═FeSO4+H2↑.
(3)某同学认为经过步骤②后所得固体就是纯净的铜,不需要进行步骤③,你认为是否合理?不合理,理由是因为要使Cu2+完全置换出来,必须加入过量的铁.
(4)步骤④的操作是蒸发,溶液2和溶液3为什么要混合?两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用.
分析 (1)此过程是对铜的分离,为了不引入新的杂质此处应放金属铁,由于是溶液与铜的分离故可采用过滤的方法完成;
(2)由于固体中含有铜与过量的铁,所以要得到纯净的铜应该消耗掉金属铁,加稀硫酸可使铁被消耗;
(3)不加稀硫酸时铁粉无法除掉,此处过量的铁粉是必须要加的,因为只有②中加入过量的铁粉才能使铜能被彻底置换出来;
(4)从溶液中得到硫酸亚铁可采用蒸发溶剂的方法进行,溶液2、3中都含有硫酸亚铁为综合利用应该使其混合.
解答 解:(1)此过程是置换出铜的过程,为了在不引入新的杂质的前提下用金属铁置换较为合适,由于分离的方法是溶液与铜的分离故可采用过滤的方法完成,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(2)为把铜能彻底置换出来加入铁的质量应该是过量的,因此固体中含有铜与过量的铁,所以要得到纯净的铜应该消耗掉金属铁,加稀硫酸可使铁被消耗又不引入新的杂质,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(3)由于固体中既有铜又有铁,不加稀硫酸时铁粉无法除掉,此处过量的铁粉是一定存在的,因为只有②中加入过量的铁粉才能使铜能被彻底置换出来.所以为了将铁和铜分离,要进行第3步;
(4)从溶液中得到硫酸亚铁溶质可采用蒸发溶剂的方法进行,因为溶液2、3中都含有硫酸亚铁为综合利用减小浪费应该使其混合.
故答案为:(1)铁,过滤,Fe+CuSO4=FeSO4+Cu;
(2)稀硫酸,Fe+H2SO4=FeSO4+H2↑;
(3)不合理,因为要使Cu2+完全置换出来,必须加入过量的铁;
(4)蒸发,两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用.
点评 本题是一道金属回收题,解题的关键是要明确回收的原理,结合题目内的框题进行分析探讨,是一道分离混合物的综合题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列对催化剂描述正确的是( )
| A. | 只有分解反应才需要催化剂 | |
| B. | 催化剂在化学反应前后本身的质量和化学性质不变 | |
| C. | 某些化学反应可以有多种催化剂 | |
| D. | 使用催化剂可以增加生成物的质量 |
7.如果发现火险或遭遇火灾时,一定要沉着应对.下列处置不当的是( )
| A. | 洒在桌面上的酒精燃烧起来,立即用湿抹布扑盖 | |
| B. | 室内燃气泄漏时,迅速开灯检查 | |
| C. | 用湿毛巾捂住口鼻,蹲下沿墙角逃离着火区域 | |
| D. | 图书、档案起火时,用二氧化碳灭火器扑灭 |
1.验证Zn、Fe、Ag金属的活动性强弱,下列的实际组合实验方案不能达到实验目的是( )
| A. | FeSO4溶液、Zn、Ag | B. | ZnSO4溶液、稀盐酸溶液、Fe、Ag | ||
| C. | ZnCl2溶液、Ag NO3溶液、Fe | D. | ZnSO4溶液、FeSO4溶液、Ag |
2.工业上采用氨碱法生产纯碱,主要流程如图,请据图回答相关问题.

(1)氨碱法生产所得产品为纯碱,向纯碱水溶液中滴入无色酚酞试液显红色.
(2)从步骤①提取粗盐常用蒸发结晶(填“蒸发结晶”或“降温结晶”)方法.
(3)从酸碱反应的角度分析,步骤④中通入氨气的作用是氨气溶于水呈碱性,有利于二氧化碳的吸收.
(4)步骤⑤所得的碳酸氢钠在生产和生活中有许多重要用途,请写出它的一种用途治疗胃酸过多.
(5)步骤⑥中发生反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,该反应类型属于分解反应.
(6)工业产品中往往含有一些杂质,用“氨碱法”制得的纯碱含有少量氯化钠.为了测定该产品中碳酸钠的纯度,进行以下实验:取16.5g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
请你据此分析计算:
②实验中产生二氧化碳的质量为6.6g;
②该产品中碳酸钠的质量分数(写出计算过程,结果精确到0.1%)

(1)氨碱法生产所得产品为纯碱,向纯碱水溶液中滴入无色酚酞试液显红色.
(2)从步骤①提取粗盐常用蒸发结晶(填“蒸发结晶”或“降温结晶”)方法.
(3)从酸碱反应的角度分析,步骤④中通入氨气的作用是氨气溶于水呈碱性,有利于二氧化碳的吸收.
(4)步骤⑤所得的碳酸氢钠在生产和生活中有许多重要用途,请写出它的一种用途治疗胃酸过多.
(5)步骤⑥中发生反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,该反应类型属于分解反应.
(6)工业产品中往往含有一些杂质,用“氨碱法”制得的纯碱含有少量氯化钠.为了测定该产品中碳酸钠的纯度,进行以下实验:取16.5g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
②实验中产生二氧化碳的质量为6.6g;
②该产品中碳酸钠的质量分数(写出计算过程,结果精确到0.1%)