题目内容
11. (1)葡萄糖酸钙相对分子质量为430;
(1)葡萄糖酸钙相对分子质量为430;(2)葡萄糖酸钙中氢、氧元素的质量比为11:112;
(3)按说明书服用钙片时,每天能够补充的钙为 mg(精确到0.1).
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据每片含葡萄糖酸钙0.2g,每日2次,每次1片,进行分析解答.
解答 解:(1)葡萄糖酸钙的相对分子质量为(12×6+1×11+16×7)×2+40=430.
(2)葡萄糖酸钙中氢、氧元素的质量比是(1×22):(16×14)=11:112.
(3)每片含葡萄糖酸钙0.2g,每日2次,每次1片,按说明书服用钙片时,每天摄入的葡萄糖酸钙的质量为0.2g×2×$\frac{40}{430}$×100%≈0.0372g=37.2mg.
故答案为:(1)430;(2)11:112;(3)37.2.
点评 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算等进行分析问题、解决问题的能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
13.大自然中学锦绣同学向2g碳酸钠、氢氧化钠、氧化钙的混合物中加入100g水,混合后恰好完全反应后过滤,将滤液蒸干,滤液减少的质量为99.82g,则锦绣同学所取混合物中碳酸钠和氢氧化钠的质量比为( )
| A. | 53:40 | B. | 53:19 | C. | 53:80 | D. | 53:28 |
6.下列实验操作中,正确的是( )
| A. |  闻气味 | B. |  点燃酒精灯 | C. |  取固体药品 | D. |  量9.5mL液体 |
16.用饱和食盐水和碳酸氢铵反应可以获得碳酸氢钠:NH4HCO3+NaCl═NaHCO3↓+NH4Cl(20℃时,NH4HCO3溶解度为21g,NaCl溶解度为36g,NaHCO3溶解度为9.6g).下列关于该反应的叙述正确的是( )
| A. | NaHCO3是碱 | |
| B. | 该反应中四种物质都是盐 | |
| C. | 该反应不符合复分解反应发生的条件 | |
| D. | 析出晶体后剩余溶液中的溶质只有NH4Cl一种 |
3.下列所示的四个图象,能正确反应对应变化关系的是( )
| A. |  水的电解 | |
| B. | 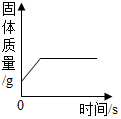 将一定质量硫酸铜溶液倒入盛有铁钉的烧杯 | |
| C. |  加热一定量KMnO4固体 | |
| D. | 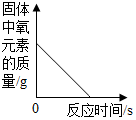 向少量的H2O2溶液中加入MnO2固体 |
20.下列实验方案中,不能证明NaOH溶液与稀盐酸发生了反应的是( )
| A. | 向一定量的NaOH溶液中通入CO2后再滴加稀盐酸,有气体生成 | |
| B. | 向装有一定量NaOH溶液的烧杯中滴几滴酚酞溶液,再逐滴加入稀盐酸 | |
| C. | 先测定NaOH溶液的pH,再逐滴加入稀盐酸,溶液的pH数值逐渐降低 | |
| D. | 向装有少量稀盐酸的试管中滴加足量NaOH溶液,再向其中滴加Na2CO3溶液 |
