题目内容
14.生活中常用管道煤气(主要成分C4H10)和天然气(主要成分CH4)两种燃料.若完全燃烧等质量的C4H10和CH4,C4H10消耗氧气的质量<CH4消耗氧气的质量(填“>”、“<”或“=”)分析 煤气燃烧生成水和二氧化碳,甲烷燃烧生成水和二氧化碳,根据煤气和甲烷的质量及其反应的化学方程式可以计算消耗氧气的质量.
解答 解:C4H10、CH4燃烧的化学方程式及其反应物之间的质量关系为:
2C4H10+13O2$\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O,CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
116 416 16 64
因为$\frac{116}{16}$<$\frac{416}{64}$,所以完全燃烧等质量的C4H10和CH4,C4H10消耗氧气的质量小于CH4消耗氧气的质量.
故填:<.
点评 解答时,不用计算出具体的数值即可判断消耗氧气质量的大小关系,要注意掌握这种解答方法.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
5.小亮同学在实验室中制取CO2气体后,对废液进行后续探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图1所示;加入Na2CO3溶液的质量与溶液pH的变化关系如图2所示.下列说法中正确的是( )

| A. | 图1中0→a段表示生成沉淀的过程 | |
| B. | 图1中a的值为106 | |
| C. | 图1中c点时,溶液中的溶质有两种 | |
| D. | 图1中b→c的反应过程中溶液的pH变化情况可用图2中h→k段曲线表示 |
9.下列有关实验操作或现象描述正确的是( )
| A. | 向蛋清溶液中加入饱和的硫酸铵溶液,产生白色沉淀为化学反应 | |
| B. | 用湿润的蓝色石蕊试纸检验氨气时,试纸变为红色 | |
| C. | 用玻璃棒蘸取少量试液滴在湿润的PH试纸上,与标准比色卡对照并读出PH | |
| D. | 碘水滴在馒头片上,出现蓝色 |
19.我国每年“安全教育日”普及安全知识.下列有关安全措施的做法不正确的是( )
| A. | 进入久未开启的菜窖前,先用燃着的蜡烛进行试验 | |
| B. | 烧菜时油锅着火,立即用锅盖盖灭 | |
| C. | 用聚乙烯(PVC)塑料保鲜膜包装食品 | |
| D. | 用氢氧化钠溶液处理硫在氧气中燃烧产生的气体 |
3.下列有关说法正确的是( )
| A. | 常温下,过氧化氢溶液极易分解产生氧气 | |
| B. | 验满氧气的方法是用带火星的木条靠近集气瓶口 | |
| C. | 配制一定质量分数的NaCl溶液必需的玻璃仪器只有烧杯和玻棒 | |
| D. | 露置在空气中的氢氧化钠,其成分不会发生变化 |

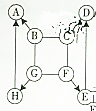 如图所示,A-H是初中化学常见的物质,图中“→”表示一种物质能转化为另一种物质,“-”表示两种物质能发生反应(部分反应物、生成物及反应条件未示出).其中A、G为常见的金属,E、H常温下为气体,E能形成温室效应,D常温下为液体,C是一种碱,在生活中可用来去除油污.请根据图填写下列空格:
如图所示,A-H是初中化学常见的物质,图中“→”表示一种物质能转化为另一种物质,“-”表示两种物质能发生反应(部分反应物、生成物及反应条件未示出).其中A、G为常见的金属,E、H常温下为气体,E能形成温室效应,D常温下为液体,C是一种碱,在生活中可用来去除油污.请根据图填写下列空格: 向盛有200g稀盐酸溶液的烧杯中加入一定量的铁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示,请回答:
向盛有200g稀盐酸溶液的烧杯中加入一定量的铁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示,请回答: