题目内容
19.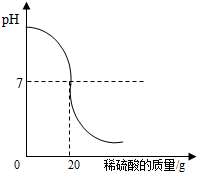 为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.
为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.
分析 由所滴加的稀硫酸质量与溶液的pH变化的函数关系图,在加入20g稀硫酸所得溶液pH=7时,硫酸与氢氧化钠恰好反应;根据反应的化学方程式,由消耗稀硫酸的质量计算硫酸钠的质量,进而计算所得溶液中溶质的质量分数.
解答 解:由关系图,加入20g稀硫酸所得溶液pH=7时,硫酸与氢氧化钠恰好反应;
设硫酸钠质量是x
H2SO4 +2NaOH═Na2SO4+2H2O
98 142
20g×4.9% x
$\frac{98}{142}=\frac{20g×4.9%}{x}$
x=1.42g
所得溶液的质量分数:$\frac{1.42g}{45g}×100%$=3.2%
答:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数是3.2%.
点评 此题是对中和反应的考查题,借助图象找到恰好反应点是解题的关键,分析知PH=7时两种物质正好反应.

练习册系列答案
相关题目
9.2009年世界气候大会在在丹麦首都哥本哈根举行,旨在控制空气中二氧化碳、甲烷和其它造成温室效应气体的排放,将温室气体的浓度稳定在使气候免遭破坏的水平上.控制二氧化碳的排放需要人人做起,“低碳生活“有望成为新的时尚流行全球.“低碳生活“是指生活作息时,耗用的能量少,从而减低碳,特别是二氧化碳的排放.下面不属于低碳生活方式的是( )
| A. | 将呼吸产生的二氧化碳用石灰水吸收 | |
| B. | 经常骑自行车上下班 | |
| C. | 多用邮电、QQ等通讯方式,少用传真打印机 | |
| D. | 吃天然食品,穿棉质服装 |
10.下列实验现象描述正确的是( )
| A. | 在空气中点燃硫粉,产生明亮的蓝紫色火焰,放出热量 | |
| B. | 镁在空气中燃烧,发出强光,放出热量,产生大量的白雾 | |
| C. | 向硫酸铜溶液中加入铁钉:铁钉表面有一层红色物质,溶液变成浅绿色 | |
| D. | 硝酸铵与熟石灰混合研磨:白色固体中产生刺激性气味气体 |
14. 如图,小军对所学知识进行了归纳,其中甲与乙、丙、丁…不是都能反应的一组是( )
如图,小军对所学知识进行了归纳,其中甲与乙、丙、丁…不是都能反应的一组是( )
 如图,小军对所学知识进行了归纳,其中甲与乙、丙、丁…不是都能反应的一组是( )
如图,小军对所学知识进行了归纳,其中甲与乙、丙、丁…不是都能反应的一组是( )| 甲 | 乙、丙、丁… | |
| A | O2 | Cu、H2、CO |
| B | CuO | C、CO、H2SO4 |
| C | CO2 | Ba(OH)2、H2O、C |
| D | CuSO4 | Fe、HCl、Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
6.某粒子的结构示意图如图所示,对该粒子的说法错误的是( )


| A. | 核电荷数为12 | |
| B. | 核外有3个电子层 | |
| C. | 带12个单位正电荷 | |
| D. | 在化学反应中,易失去最外层上的2个电子 |


