题目内容
7.实验室常用的干燥剂“碱石灰”是氧化钙和氢氧化钠固体的混合物,极易与空气中水蒸汽和二氧化碳反应而变质.某同学对一瓶久置的“碱石灰”作了如下探究:(1)【猜想】
猜想1:没有变质,“碱石灰”只含有氧化钙和氢氧化钠;
猜想2:已完全变质,“碱石灰”全部变成了碳酸钙和碳酸钠.
则氧化钙与水反应的反应方程式为CaO+H2O═Ca(OH)2.
(2)【实验】如图所示:

(3)【判断】
a.若氢氧化钙、碳酸钙和碳酸钠投入到水中不会放热,则由操作②现象判断:猜想2不成立(填:成立或不成立);
b.欲判断猜想1是否成立,操作⑤应加入的试剂是盐酸(填物质名称),操作⑥发生的化学反应方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
C.综合a和b的结论,判断该样品变质情况为部分变质.
(4)【拓展】由上述实验说明,实验室中“碱石灰”应密封、防潮保存.
分析 氧化钙能与水反应生成氢氧化钙,根据物质溶于水的温度变化情况进行分析,根据推导确定混合物的成分进行分析,根据实验现象进行分析,根据上面的实验结论进行分析.
解答 解:氧化钙能与水反应生成氢氧化钙,故填:CaO+H2O═Ca(OH)2;
(1)混合物加水后试管壁发热,但是Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,所以猜想三不成立,故填:不成立.
(2)浑浊液中的滤渣中滴加盐酸,产生气泡,说明混合物中有碳酸钙,滤液中滴加盐酸有气泡,加澄清石灰水有沉淀生成,说明滤液中有碳酸钠,但是如果只有氧化钙和氢氧化钠就不会生成碳酸钙沉淀和碳酸钠,故一定含有碳酸钠.
(3)通过实验可知,碱石灰在空气中极易变质.
(4)存放碱石灰时要注意密封防潮.
故答案为:CaO+H2O═Ca(OH)2
(1)不成立;
(2)盐酸;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)部分变质
(4)密封、防潮
点评 本题考查的是混合物变质成分的实验探究,完成此题,可以依据已有的知识进行.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
18.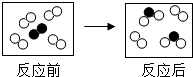 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )| A. | 有单质生成 | B. | 是化合反应 | ||
| C. | 参加反应的两种分子个数比为4:1 | D. | 反应前后元素的化合价没有变 |
2.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是( )
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | CO2 | CO | 通入O2,点燃 |
| B | NaOH固体 | Na2CO3固体 | 加入过量盐酸,蒸发 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | CuO固体 | Cu固体 | 加入适量的稀硫酸溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |




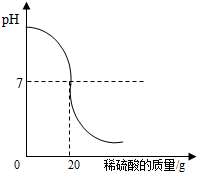 为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.
为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.