题目内容
18.某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成.分四次取样品与稀硫酸反应,其实验数据记录如表.| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量 | 0.4 | 0.8 | 1.0 | 1.0 |
(1)在四份样品所做的实验中,硫酸有剩余的是3、4;
(2)列式计算所用稀硫酸中溶质的质量分数
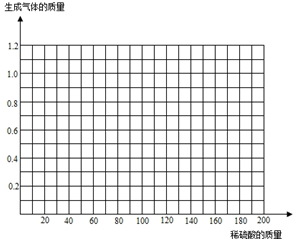
(3)请在图中画出在50.0g样品中加入稀硫酸的质量与产生气体质量变化关系的示意图.
(4)请计算恰好完全反应时溶液中溶质的质量分数.
分析 根据金属与酸反应的条件可知,锌与酸反应,铜与酸不反应.再由表中数据分析可知,第三次反应是合金中的锌反应完了,前两次是酸完全反应,合金有剩余,再正确写出方程式,由方程式求出锌与硫酸的质量,就可以求得黄铜中锌的质量分数和所用稀硫酸中溶质的质量分数.
解答 解:(1)由图表数据可以看出,第3、4次反应生成气体的质量相等,而加入的稀硫酸的质量是以40g/次增加的,且前两次每次生成的氢气的质量为0.4g,第三次增加40g稀硫酸,此时增加气体的质量为1.0g-0.8g=0.2g,恰好反应时需要硫酸质量为100g,结合第四次的反应,可以判断第三、四次稀硫酸有剩余.
(2)设合金中含锌的质量为x,稀硫酸中含硫酸的质量为y,生成硫酸锌的质量为z,
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x y z 1.0g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{161}{z}$=$\frac{2}{1.0g}$
解得:x=32.5g,y=49g,z=80.5g
所用稀硫酸中溶质的质量分数=$\frac{49g}{100g}$×100%=49%
(3)当没有硫酸加入时,就没有气体的放出,因此起点是(0,0);比较第一份和第二份可以发现,每加入40克硫酸,气体就会多放出0.4克,因此要想放出1.0克气体,需要加入硫酸的质量是100克,因此最高点是(100,1.0);比较第一份和第二份可以发现,硫酸的质量和气体的质量的比值相等(斜率相同),所以图象是一条直线.
(4)恰好完全反应时溶液中溶质的质量分数为$\frac{80.5g}{32.5g+100g-1.0g}$×100%=61.2%
故答案为:(1)3、4;
(2)49%(3) (4)61.2%.
(4)61.2%.
点评 本题主要考查学生利用化学方程式和溶质质量分数公式解答问题的能力.与正确解答本题,须知铜不与稀硫酸反应.

 考前必练系列答案
考前必练系列答案| A. | 4Na+3CO2↑═C+2Na2CO3 | B. | Na+CO2$\frac{\underline{\;440℃\;}}{高温}$C+Na2CO3 | ||
| C. | 2Na+3CO2$\frac{\underline{\;440℃\;}}{高压}$C+2NaCO3 | D. | 4Na+3CO2$\frac{\underline{\;440℃\;}}{高压}$C+2Na2CO3 |
| A. | NaCl+KNO3═KCl+NaNO3 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Fe+Cu(NO3)2═Fe(NO3)2+Cu | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| A. | 倒回原试剂瓶 | B. | 随意倾倒到水槽中 | ||
| C. | 带回家中 | D. | 倒到指定的容器中 |
| A. | 氧气 | B. | 氮气 | C. | 水蒸气 | D. | 二氧化碳 |
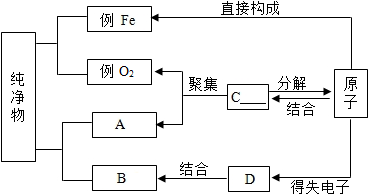 如图是构成纯净物的粒子间的关系图.请在A、B处填入任何一个符合题意的物质的名称,C、D处填入粒子名称(填分子、原子或离子).
如图是构成纯净物的粒子间的关系图.请在A、B处填入任何一个符合题意的物质的名称,C、D处填入粒子名称(填分子、原子或离子).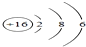 (1)化学用语是最简明、信息丰富、国际通用的语言.请用化学用语填空:
(1)化学用语是最简明、信息丰富、国际通用的语言.请用化学用语填空: