题目内容
6.海水晾晒制得的粗盐中除含NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质.在实验室里用一定质量的粗盐制备精盐的操作流程如下: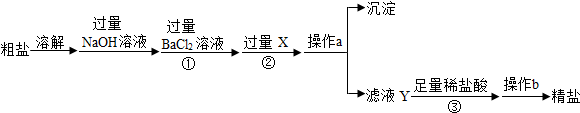
已知:2NOH+MgCl2═Mg(OH)2↓+2NaCl
(1)操作a是过滤,X是Na2CO3溶液.
(2)第①步中发生反应的化学方程式是Na2SO4+BaCl2=BaSO4↓+2NaCl.
(3)第③步中加入足量稀盐酸的目的是除去多余的氢氧化钠和碳酸钠,此步骤中发生反应的一个化学方程式是NaOH+HCl=NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
分析 (1)根据难溶性固体和液体分离 方法分析操作;根据除去杂质氯化钡和氯化钙选择合适的试剂;
(2)根据氯化钡的作用写出反应的方程式;
(3)根据滤液中溶质含有碳酸钠和氢氧化钠分析盐酸的作用并写出反应的方程式.
解答 解:(1)操作a是将沉淀和滤液的分离,因此是过滤;经过氢氧化钠、氯化钡的除杂后仍然存在氯化钙和过量的氯化钡杂质,因此可以滴加过量的碳酸钠溶液;故答案为:过滤;Na2CO3溶液;
(2)加入过量的氯化钡,钡离子可以将硫酸根离子转化为沉淀,因此操作加入过量的BaCl2目的是除去粗盐中的硫酸钠,反应的化学方程式Na2SO4+BaCl2=BaSO4↓+2NaCl;故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)最后得到的滤液中溶质除含有氯化钠外还含有碳酸钠和氢氧化钠,因此加入适量盐酸的目的是除去多余的氢氧化钠和碳酸钠.反应的方程式为:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;故答案为:除去多余的氢氧化钠和碳酸钠;NaOH+HCl=NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 本题主要考查了粗盐提纯的方法,解题的关键是对难溶性杂质可溶性杂质的去除方法的掌握,并将知识灵活应用.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
17. 对二甲苯(简称PX):无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物.如图是“PX”的结构式,下列有关“PX”的说法不正确的是( )
对二甲苯(简称PX):无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物.如图是“PX”的结构式,下列有关“PX”的说法不正确的是( )
 对二甲苯(简称PX):无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物.如图是“PX”的结构式,下列有关“PX”的说法不正确的是( )
对二甲苯(简称PX):无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物.如图是“PX”的结构式,下列有关“PX”的说法不正确的是( )| A. | “PX”属于有机化合物 | B. | “PX”的化学式为C8H10 | ||
| C. | “PX”中C、H两种元素的质量比为4:5 | D. | “PX”完全燃烧后产生二氧化碳和水 |
16. 盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如图所示.下列说法正确的是( )
盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如图所示.下列说法正确的是( )
 盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如图所示.下列说法正确的是( )
盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如图所示.下列说法正确的是( )| A. | MgSO4的溶解度始终随温度的升高而减小 | |
| B. | t1℃时,KCl和MgSO4两溶液所含溶质的质量一定相等 | |
| C. | t2℃时,100g MgCl2的饱和溶液中含有ag MgCl2 | |
| D. | 将t2℃时的MgSO4饱和溶液降温到t1℃,溶液的变化是:饱和→不饱和→饱和 |



 水与我们日常生活密切相关
水与我们日常生活密切相关 如图是3种固体物质的溶解度曲线,请你根据曲线回答下列问题:
如图是3种固体物质的溶解度曲线,请你根据曲线回答下列问题: