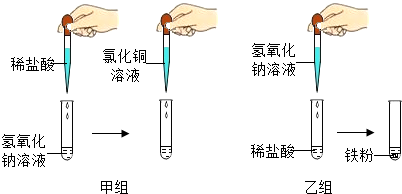
题目内容
15.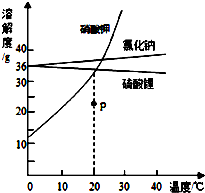 如图是3种固体物质的溶解度曲线,请你根据曲线回答下列问题:
如图是3种固体物质的溶解度曲线,请你根据曲线回答下列问题:(1)P 点表示硝酸钾的不饱和(填“饱和”或“不饱和”)溶液.
(2)20℃时,分别将硝酸钾和硫酸锂的饱和溶液降温到0℃,溶质质量分数硝酸钾小于硫酸锂.(填“大于”或“等于”或“小于”)
(3)总结氯化钠和硫酸锂的溶解度随温度的变化规律:
不同点:氯化钠溶解度随温度升高而增大;硫酸锂溶解度随温度升高而减小.相同点:氯化钠和硫酸锂的溶解度受温度变化小.
分析 根据题目信息和溶解度曲线可知:硝酸钾、氯化钠两种固体物质的溶解度,都是随温度升高而增大,而硫酸锂的溶解度随温度的升高而减少;P点表示硝酸钾的不饱和溶液,因为p点在硝酸钾的溶解度曲线下方;20℃时,分别将硝酸钾和硫酸锂的饱和溶液降温到0℃,溶质质量分数硝酸钾小于硫酸锂的,因为硝酸钾有固体析出,硫酸锂质量分数没有改变;氯化钠和硫酸锂的溶解度随温度的变化规律:不同点,氯化钠溶解度随温度升高而增大;硫酸锂溶解度随温度升高而减小;相同点,氯化钠和硫酸锂的溶解度受温度变化小.
解答 解:(1)P点表示硝酸钾的不饱和溶液,因为p点在硝酸钾的溶解度曲线下方;故答案为:不饱和
(2)20℃时,分别将硝酸钾和硫酸锂的饱和溶液降温到0℃,溶质质量分数硝酸钾小于硫酸锂的,因为硝酸钾有固体析出,硫酸锂质量分数没有改变;故答案为:小于
(3)氯化钠和硫酸锂的溶解度随温度的变化规律:不同点,氯化钠溶解度随温度升高而增大;硫酸锂溶解度随温度升高而减小;相同点,氯化钠和硫酸锂的溶解度受温度变化小;故答案为:不同点:氯化钠溶解度随温度升高而增大;硫酸锂溶解度随温度升高而减小;相同点:氯化钠和硫酸锂的溶解度受温度变化小.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了饱和溶液和不饱和溶液的相互转化等,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
5.下列对实验现象描述不正确的是( )
| A. | 硫在空气中燃烧发出淡蓝色火焰 | |
| B. | 铁丝在空气中剧烈燃烧,火星四射 | |
| C. | 打开盛浓盐酸试剂瓶的瓶塞,瓶口有白雾出现 | |
| D. | 向碎鸡蛋壳中滴加稀盐酸,有气泡产生 |
20.关注健康,预防疾病.下列叙述正确的是( )
| A. | 人体血液的PH范围为0.9-1.5 | |
| B. | 碘摄取量过多也能导致甲状腺肿大 | |
| C. | 维生素在人体内部不能合成 | |
| D. | 油酯、蛋白质、糖类都能为人体提供能量,其中油脂是主要供能物质 |
4.除去下列物质中的杂质,所选用的方法正确的是:( )
| 物质(括号内为杂质) | 操作方法 | |
| A | CO2(HCl) | 先通过过量氢氧化钠溶液,再通过浓硫酸 |
| B | 铁粉(锌粉) | 加过量FeSO4溶液充分反应后过滤、洗涤、干燥 |
| C | CO2溶液(CO) | 通入氧气后,点燃 |
| D | NaCl溶液(Na2CO3) | 加稀硫酸至恰好不再产生气泡为止 |
| A. | A | B. | B | C. | C | D. | D |
5.如图是镁的原子结构示意图及其在元素周期表中的部分内容,下列说法正确的是( )
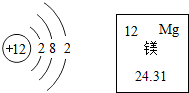
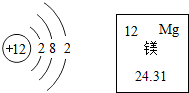
| A. | 镁是非金属元素 | B. | 镁的化学性质比较稳定 | ||
| C. | 镁的相对原子质量是24.31g | D. | 镁原子易失去电子成为阳离子 |