题目内容
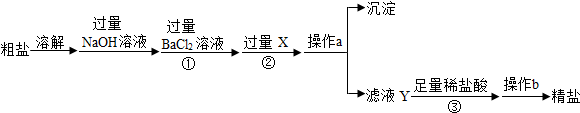
16.现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成.为确定其组成,进行了如图所示的实验(假设实验过程无损耗),请回答:
(1)根据上述实验判断:无色气体是二氧化碳;固体粉末中一定有碳酸钠.
向实验后的X溶液中加入稀硝酸和硝酸银溶液,出现白色沉淀,则有同学推断“所加稀盐酸一定过量”,请你说出该推断是正确或是错误的理由?错误,因为盐酸与碳酸钠反应生成的氯化钠与硝酸银反应也能生成不溶于硝酸的白色沉淀.
(2)若实验取固体粉末20g,生成白色沉淀10g,最后得到溶质质量分数为5.85%的X溶液200g(只含一种溶质),则X溶液中溶质的质量是11.7g;固体粉末由CaCO3、CaO、Na2CO3(填化学式)组成.
分析 根据碳酸钙难溶于水,氧化钙会与水反应生成氢氧化钙,氢氧化钙和碳酸钠会生成白色的碳酸钙沉淀和氢氧化钠,碳酸钠和盐酸反应会生成氯化钠、水和二氧化碳等知识进行分析.
解答 解:碳酸钙难溶于水,氧化钙会与水反应生成氢氧化钙,氢氧化钙和碳酸钠会生成白色的碳酸钙沉淀和氢氧化钠,碳酸钠和盐酸反应会生成氯化钠、水和二氧化碳.
(1)通过分析,无色溶液和盐酸反应会生成气体,所以固体粉末中一定含有碳酸钠,无色气体是二氧化碳;
氯离子和银离子会生成氯化银沉淀,所以推断是错误的理由是:因为盐酸与碳酸钠反应生成的氯化钠与硝酸银反应也能生成不溶于硝酸的白色沉淀;
(2)根据(1)的解答可知X溶液为氯化钠溶液其质量为:200g×5.85%=11.7g,根据题意结合化学方程式,可以求出与盐酸反应的碳酸钠的质量为10.6g,进而可以判断出该固体粉末的组成为:CaCO3、CaO、Na2CO3 .
解:设碳酸钠的质量为x,则:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117
x 11.7g
$\frac{106}{x}$=$\frac{117}{11.7g}$
解得x=10.6g
故答案为:(1)二氧化碳,碳酸钠;
错误,因为盐酸与碳酸钠反应生成的氯化钠与硝酸银反应也能生成不溶于硝酸的白色沉淀;
(2)11.7g,CaCO3、CaO、Na2CO3.
点评 本题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据物质的化学特性直接得出结论,然后利用顺推或逆推或从两边向中间推断,逐步得出其他结论.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
11.分类时学习化学的方法之一,下列物质按单质、氧化物、混合物顺序排列的是( )
| A. | 氢气、氧气、空气 | B. | 氮气、冰、生铁 | ||
| C. | 水、四氧化三铁、石油 | D. | 铜、碳酸钙、加碘食盐 |
1.霓虹灯装扮了城市的夜晚,在霓虹灯中填充的气体是( )
| A. | 氧气 | B. | 稀有气体 | C. | 二氧化碳 | D. | 氮气 |
5.下列对实验现象描述不正确的是( )
| A. | 硫在空气中燃烧发出淡蓝色火焰 | |
| B. | 铁丝在空气中剧烈燃烧,火星四射 | |
| C. | 打开盛浓盐酸试剂瓶的瓶塞,瓶口有白雾出现 | |
| D. | 向碎鸡蛋壳中滴加稀盐酸,有气泡产生 |




 对“高低不同的燃着的蜡烛罩上大茶杯后谁先熄灭?”这一问题,甲、乙同学设计了如图所示的实验来验证自己的猜想.实验中将两支燃着的蜡烛罩上大茶杯,过一会儿,2支蜡烛先后都熄灭了,甲、乙同学都认为是二氧化碳浓度高,氧气不足造成了:
对“高低不同的燃着的蜡烛罩上大茶杯后谁先熄灭?”这一问题,甲、乙同学设计了如图所示的实验来验证自己的猜想.实验中将两支燃着的蜡烛罩上大茶杯,过一会儿,2支蜡烛先后都熄灭了,甲、乙同学都认为是二氧化碳浓度高,氧气不足造成了: