题目内容
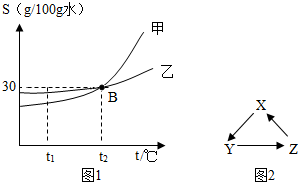 (1)如图1是甲、乙两种物质的溶解度曲线.
(1)如图1是甲、乙两种物质的溶解度曲线.①t2℃时,溶解15g甲物质,至少需要
②t2℃时,在烧杯中分别盛有等质量的甲、乙两种溶质的饱和溶液,从t2℃降温到t1℃时,对烧杯中剩余溶液描述正确的是
a.溶质的质量分数:甲>乙 b.析出固体的质量:甲>乙
c.甲是饱和溶液,乙是不饱和溶液 d.溶剂的质量:甲<乙
(2)X、Y、Z三种物质有如图2所示的转化关系.
①若X为金属单质,Z为含X元素的可溶性盐.写出Y→Z且能体现酸的性质的反应方程式一个:
②若X为Ca(OH)2,则Y是
考点:固体溶解度曲线及其作用,晶体和结晶的概念与现象,金属的化学性质,碱的化学性质,物质的鉴别、推断
专题:常见物质的推断题,溶液、浊液与溶解度
分析:(1)①据该 温度下甲的溶解度回答;
②甲、乙的溶解度均随 温度的降低而减小,降温时溶剂的质量不变,据此解答;
(2)①据金属和氧气反应生成金属氧化物,金属氧化物和酸反应生成可溶性的盐和水,据此分析解答;
②据氢氧化钙、碳酸钙和氧化钙的相互转化分析解答.
②甲、乙的溶解度均随 温度的降低而减小,降温时溶剂的质量不变,据此解答;
(2)①据金属和氧气反应生成金属氧化物,金属氧化物和酸反应生成可溶性的盐和水,据此分析解答;
②据氢氧化钙、碳酸钙和氧化钙的相互转化分析解答.
解答:解:(1)①t2℃时甲的溶解度是30g,即100g水中最多溶解30g甲,所以要溶解15g甲物质,至少需要 50g水;
②t2℃时,在烧杯中分别盛有等质量的甲、乙两种溶质的饱和溶液,从t2℃降温到t1℃时,甲的溶解度变化较大,析出晶体多,乙的溶解度变化较小,析出晶体少,降温时溶剂的质量不变;
a、从t2℃降温到t1℃时,甲、乙的溶解度都减小,依然是饱和溶液,饱和溶液中溶质的质量分数是
×100%,所以溶解度大则溶质的质量分数大,而t1℃时乙的溶解度大于甲的溶解度,故溶质的质量分数大小关系是乙大于甲,故错误;
b、从t2℃降温到t1℃时,甲的溶解度变化较大,析出晶体多,乙的溶解度变化较小,析出晶体少,正确;
c、由a分析可知:甲、乙降温后均是饱和溶液,故错误;
d、降温时溶剂的质量不变,故烧杯中剩余溶液溶剂的质量相等,故错误;
(2)①据金属和氧气反应生成金属氧化物,金属氧化物和酸反应生成可溶性的盐和水,若X是铜,则Y是氧化铜,氧化铜和硫酸反应生成硫酸铜和水,方程式是:CuO+H2SO4═CuSO4+H2O;
②若X为Ca(OH)2,氢氧化钙可与二氧化碳、碳酸钠反应生成碳酸钙,碳酸钙高温生成氧化钙;
故答案为:(1)①50; ②b;
(2)①CuO+H2SO4═CuSO4+H2O(合理答案均可);
②CaCO3; CaO.
②t2℃时,在烧杯中分别盛有等质量的甲、乙两种溶质的饱和溶液,从t2℃降温到t1℃时,甲的溶解度变化较大,析出晶体多,乙的溶解度变化较小,析出晶体少,降温时溶剂的质量不变;
a、从t2℃降温到t1℃时,甲、乙的溶解度都减小,依然是饱和溶液,饱和溶液中溶质的质量分数是
| 溶解度 |
| 溶解度+100g |
b、从t2℃降温到t1℃时,甲的溶解度变化较大,析出晶体多,乙的溶解度变化较小,析出晶体少,正确;
c、由a分析可知:甲、乙降温后均是饱和溶液,故错误;
d、降温时溶剂的质量不变,故烧杯中剩余溶液溶剂的质量相等,故错误;
(2)①据金属和氧气反应生成金属氧化物,金属氧化物和酸反应生成可溶性的盐和水,若X是铜,则Y是氧化铜,氧化铜和硫酸反应生成硫酸铜和水,方程式是:CuO+H2SO4═CuSO4+H2O;
②若X为Ca(OH)2,氢氧化钙可与二氧化碳、碳酸钠反应生成碳酸钙,碳酸钙高温生成氧化钙;
故答案为:(1)①50; ②b;
(2)①CuO+H2SO4═CuSO4+H2O(合理答案均可);
②CaCO3; CaO.
点评:明确溶解度曲线的意义、溶解度概念的含义,及物质之间的相互转化,物质的性质等知识,才能正确解答,较好考查了学生分析、解决问题的能力.

练习册系列答案
相关题目
下列物质在氧气中燃烧,产生大量白烟的是( )
| A、硫 | B、铁丝 | C、蜡烛 | D、红磷 |
下列“化学造福人类”的事例中不属于化学变化的是( )
| A、用铁矿石冶炼钢铁 |
| B、用小麦、大米酿造酒、醋 |
| C、用煤为原料制取药物 |
| D、用石油分馏制取汽油 |
 已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题:
已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题: 儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:
儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答: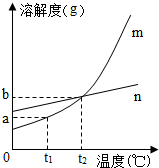 甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.
甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题. 能源和环境与人类的生活和社会发展密切相关.
能源和环境与人类的生活和社会发展密切相关.