题目内容
3.某课外活动小组的同学查阅资料得知,传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐.该小组的同学将这三种物质混合后加入适量的水搅拌、过滤得滤渣和滤液,并对料浆澄清液(“滤液”)的主要成分进行探究.【提出问题】料液的主要成分(H2O除外)是什么?
【关于料液的猜想】
小东认为:滤液中含有NaCl、Na2CO3、Ca(OH)2
小西认为:滤液中含有NaCl、NaOH、Na2CO3
小南认为:滤液中含有NaCl、NaOH、Ca(OH)2
小北认为:滤液中含有NaCl、NaOH
(1)大家讨论后一致认为小东的猜想一定不成立,理由是(用化学方程式表示)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【设计实验探究】
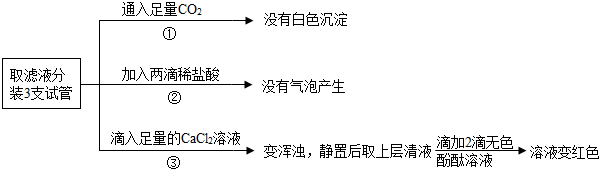
(2)根据实验①可知小南的猜想不成立,根据实验③可知小西的猜想成立,通过实验②无法判断小西的猜想能否成立,理由是稀盐酸太少,如果不足以和氢氧化钠反应时,即使含有碳酸钠,也不产生气泡.
【应用拓展】
(3)松花蛋味道鲜美,但直接食用会稍有涩味.如果将松花皮蛋蘸上食醋(填常见的一种调料)食用,则轻微涩味会被去除,味道变得更为鲜美可口.
(4)现在有的皮蛋厂直接用烧碱(NaOH)代替生石灰和纯碱,但制得的皮蛋口感却不鲜美.烧碱一定要密封保存,其理由是AB(选序号填空).
A.烧碱易吸水潮解 B.烧碱易吸收空气中的CO2而变质
C.烧碱具有强腐蚀性 D.烧碱溶于水时放出热量.
分析 (1)氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠;
(2)二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水;
向氢氧化钠溶液和碳酸钠溶液的混合溶液中滴加稀盐酸时,稀盐酸先和氢氧化钠反应,氢氧化钠完全反应后,稀盐酸再和碳酸钠反应;
碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(3)食醋中含有醋酸,醋酸能和显碱性的物质发生化学反应;
(4)氢氧化钠能够吸收空气中的水蒸气和二氧化碳.
解答 解:(1)大家讨论后一致认为小东的猜想一定不成立,理由是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:小东;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(2)根据实验①可知小南的猜想不成立,根据实验③可知小西的猜想成立,通过实验②无法判断小西的猜想能否成立,理由是:稀盐酸太少,如果不足以和氢氧化钠反应时,即使含有碳酸钠,也不产生气泡.
故填:小南;小西;稀盐酸太少,如果不足以和氢氧化钠反应时,即使含有碳酸钠,也不产生气泡.
(3)松花蛋味道鲜美,但直接食用会稍有涩味.如果将松花皮蛋蘸上食醋食用,则轻微涩味会被去除,味道变得更为鲜美可口.
故填:食醋.
(4)烧碱一定要密封保存,其理由是烧碱易吸水潮解,烧碱易吸收空气中的CO2而变质.
故填:AB.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列说法中正确的是( )
| A. | 合金属于纯净物 | B. | 铝是地壳中含量最多的元素 | ||
| C. | 铁在潮湿空气中容易生锈 | D. | 波尔多液可用铝桶存放 |
11. 研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶同质量、同浓度的H2O2 溶液中,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是锥形瓶,此实验中B处宜采用的气体收集方法是排水集气法.
【实验记录】
【结论】该探究过程得出的结论是相同条件下H2O2生成O2的快慢与催化剂的种类有关.
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否改变.
H2O2生成O2的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2生成O2的快慢的因素以及相关假设和实验方案)
【假设】过氧化氢溶液的质量分数可能影响化学反应的速率.
【实验方案】同温下取2份质量相等,质量分数不同的H2O2溶液,分别加入质量相等的同种催化剂,测量收集一试管气体所需的时间.
 研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶同质量、同浓度的H2O2 溶液中,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是锥形瓶,此实验中B处宜采用的气体收集方法是排水集气法.
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 5%H2O2 | 5%H2O2 |
| 催化剂 | 1g水泥块 | 1gMnO2 |
| 时间 | 165秒 | 46秒 |
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否改变.
H2O2生成O2的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2生成O2的快慢的因素以及相关假设和实验方案)
【假设】过氧化氢溶液的质量分数可能影响化学反应的速率.
【实验方案】同温下取2份质量相等,质量分数不同的H2O2溶液,分别加入质量相等的同种催化剂,测量收集一试管气体所需的时间.
18.关于催化剂有关问题的探究
(1)小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题.她设计并完成了如表所示的探究实验:
①请你帮小丽同学填写上表中未填完的空格.
②在小丽的探究实验中,“实验一”和“实验二”起的作用是对比(或对照等).
③小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是:比较MnO2在过氧化氢分解前后的质量.
第二方面的实验是利用“实验 三”反应后试管内的剩余物继续实验.接下来的实验操作、现象和结论是:倾倒掉反应后的液体,向剩余的固体中重新加入过氧化氢溶液,有大量气泡产生,说明MnO2仍然能加快过氧化氢的分解速率(化学性质没变).
(2)小红继续对过氧化氢分解生成水和氧气的实验条件进行探究.下表是她进行实验时采集的一组数据:
用10mL双氧水制取150mL氧气所需的时间(秒)
请你分析回答:
①小红在设计方案时,考虑了反应物的浓度、温度、催化剂等因素对过氧化氢分解速率的影响.
②通过该实验可得出的结论:
ⅰ.反应物的浓度越大,过氧化氢分解速率越快;
ⅱ.通过对比第2组和第3组实验数据可知,二氧化锰催化剂可加快分解速率.
ⅲ.温度越高,过氧化氢分解得越快.
(1)小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题.她设计并完成了如表所示的探究实验:
| 1 | 实验操作 | 实验现象 | 实验结论或总结 | |
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是慢. | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | 二氧化锰加入水中不产生氧气 | |
| 实验三 | 向盛有5mL5%过氧化氢溶液的试管中加入二氧化锰,伸入带火星的木条 | 有大量气泡产生,带火星的木条迅速复燃 | 二氧化锰能加快过氧化氢的分解 | |
②在小丽的探究实验中,“实验一”和“实验二”起的作用是对比(或对照等).
③小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是:比较MnO2在过氧化氢分解前后的质量.
第二方面的实验是利用“实验 三”反应后试管内的剩余物继续实验.接下来的实验操作、现象和结论是:倾倒掉反应后的液体,向剩余的固体中重新加入过氧化氢溶液,有大量气泡产生,说明MnO2仍然能加快过氧化氢的分解速率(化学性质没变).
(2)小红继续对过氧化氢分解生成水和氧气的实验条件进行探究.下表是她进行实验时采集的一组数据:
用10mL双氧水制取150mL氧气所需的时间(秒)
| 序号 | 双氧水的浓度 | 30% | 15% | 10% | 5% |
| 1 | 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 2 | 无催化剂、加热 | 360 | 480 | 540 | 720 |
| 3 | 二氧化锰催化剂、加热 | 10 | 25 | 60 | 120 |
①小红在设计方案时,考虑了反应物的浓度、温度、催化剂等因素对过氧化氢分解速率的影响.
②通过该实验可得出的结论:
ⅰ.反应物的浓度越大,过氧化氢分解速率越快;
ⅱ.通过对比第2组和第3组实验数据可知,二氧化锰催化剂可加快分解速率.
ⅲ.温度越高,过氧化氢分解得越快.
