题目内容
1. 有一包白色固体,可能含有硫酸钠、碳酸钠、氯化钡、氢氧化钠中的一种或几种,取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此推断白色固体中一定存在Na2CO3、BaCl2,一定不存在Na2SO4(均填写化学式).
有一包白色固体,可能含有硫酸钠、碳酸钠、氯化钡、氢氧化钠中的一种或几种,取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此推断白色固体中一定存在Na2CO3、BaCl2,一定不存在Na2SO4(均填写化学式).
分析 根据题目给出的信息:取少量白色固体溶于足量的水中有白色沉淀产生,在Na2SO4、Na2CO3、BaCl2、NaOH中,有白色沉淀生成的是Na2SO4、BaCl2,或Na2CO3、BaCl2;过滤后向沉淀中滴加盐酸,沉淀的量不断减少,最后消失,说明沉淀是碳酸钡,不是硫酸钡;因此该固体中一定有Na2CO3、BaCl2;一定没有硫酸钠;NaOH可能有,也可能没有,对实验现象没有影响.
解答 解:取少量白色固体溶于足量的水中有白色沉淀产生,在Na2SO4、Na2CO3、BaCl2、NaOH中,有白色沉淀生成的是Na2SO4、BaCl2,或Na2CO3、BaCl2;过滤后向沉淀中滴加盐酸,沉淀的量不断减少,最后消失,说明沉淀是碳酸钡,不是硫酸钡;因此该固体中一定有Na2CO3、BaCl2;一定没有硫酸钠;NaOH可能有,也可能没有.
故答案为:Na2CO3、BaCl2,Na2SO4.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列有关实验现象描述正确的是( )
| A. | 打开浓盐酸瓶塞,可看到大量白烟 | |
| B. | 无色酚酞试液滴入烧碱溶液变蓝色 | |
| C. | 点燃羊毛纤维能闻到烧焦的羽毛气味 | |
| D. | 铁丝在空气中燃烧生成四氧化三铁 |
 如图是初中化学中几种常见物质的反应及转化关系,A物质具有还原性,B是一种常见的气体,E的水溶液呈蓝色,如图中“-”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质,请回答:
如图是初中化学中几种常见物质的反应及转化关系,A物质具有还原性,B是一种常见的气体,E的水溶液呈蓝色,如图中“-”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质,请回答: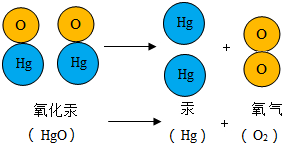 1774年,拉瓦锡用精确的定量实验研究了氧化汞分解反应中各物质质量之间的变化关系,如图是氧化汞分子分解的示意图.
1774年,拉瓦锡用精确的定量实验研究了氧化汞分解反应中各物质质量之间的变化关系,如图是氧化汞分子分解的示意图.



 如图所示为粗盐提纯的主要操作.
如图所示为粗盐提纯的主要操作.