题目内容
11.向50g质量分数为3.65%的盐酸中逐滴加入4%的氢氧化钠溶液,溶液的pH,相关物质的质量分数与加入氢氧化钠溶液质量的关系如图所示.其中合理的是( )| A. | 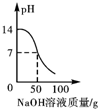 | B. | 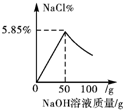 | C. | 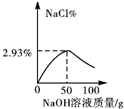 | D. | 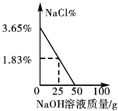 |
分析 观察图示,由所滴加的稀硫酸质量与溶液的pH变化的函数关系图,在加入25g稀硫酸所得溶液pH=7时,硫酸与氢氧化钠恰好反应;根据反应的化学方程式,由消耗氢氧化钠的质量计算所加稀硫酸中硫酸的质量,生成的硫酸钠的质量,由溶质质量分数计算公式求出稀硫酸溶质的质量分数和所得溶液中硫酸钠的质量分数.
解答 解:设恰好完全反应时消耗的氢氧化钠溶液的质量为x,反应生成氯化钠的质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
x4% 50g×3.65% y
$\frac{40}{4%x}=\frac{36.5}{50g×3.65%}=\frac{58.5}{y}$
x=50g,y=2.925g,
恰好完全反应时,所得溶液中氯化钠的质量分数为:$\frac{2.925g}{50g+50g}$×100%=2.925%≈2.93%.
A.向50g质量分数为3.65%的盐酸中逐滴加入4%的氢氧化钠溶液,开始溶液显酸性pH小于7;故图象错误;
B.由以上分析可知,所得溶液中氯化钠的质量分数为2.93%;图象错误;
C.由以上分析可知,所得溶液中氯化钠的质量分数为2.93%;图象正确;
D.向50g质量分数为3.65%的盐酸中逐滴加入4%的氢氧化钠溶液,开始没氯化钠,氯化钠的质量分数应从零开始,逐渐增大一直到反应结束;图象错误;
答案:C.
点评 本题重点考查复分解反应的实质,学会分析图象,判断产物,属于一道溶液综合性的题目.

练习册系列答案
相关题目
6.在pH=1的溶液中能大量共存且形成无色透明溶液的一组物质是( )
| A. | Na2CO3 NaCl NaOH | B. | FeCl3 KNO3 KCl | ||
| C. | Na2SO4 KCl NaCl | D. | Na2SO4 NaNO3 BaCl2 |
6.某粒子的结构示意图如图所示,对该粒子的说法错误的是( )


| A. | 核电荷数为12 | |
| B. | 核外有3个电子层 | |
| C. | 带12个单位正电荷 | |
| D. | 在化学反应中,易失去最外层上的2个电子 |






