题目内容
12.根据下列装置图回答问题(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)二氧化碳通入紫色石蕊溶液,试液变红色.
(3)实验室用一定质量的氯化钾和二氧化锰制取氧气,通过排水法测定所收集的氧气的体积(装置如图)
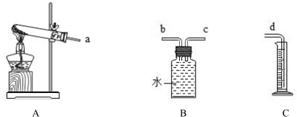
①其中二氧化锰的作用是做催化剂.
②若各装置的链接顺序是:a→b→c→d,B瓶内的导管(“b”或“c”)该怎么延伸,请在装置中画出.
③用12.25g氯酸钾和二氧化锰制取氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,氯酸钾的相对分子质量为122.5,计算完成反应后产生氧气的质量为4.8g.
(4)根据③的氧气的质量计算得出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是未冷却到室温就读数.(任写一种情况)
分析 本题主要考查二氧化碳的实验室制法和收集方法,在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.二氧化碳有三个化学性质:既不能燃烧也不能支持燃烧,还不能供给呼吸;能与水反应生成碳酸,碳酸能使紫色石蕊试液变红;能与石灰水反应(即能与碱溶液反应).在用氯酸钾和二氧化锰制氧气的实验中,二氧化锰的作用是催化作用或加快反应速度;如果测量氧气体积,连接顺序是:a→b→c→d,F装置内应该b管短c管长;如果实际测得氧气的体积大于理论值,原因可能是未冷却到室温就读数,气体体积受热造成的;根据化学方程式的计算,求反应后产生氧气的物质的量
解答 解:(1)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,在常温下反应,因此不需要加热;反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊试液变红.
(3)①二氧化锰的作用是催化作用或加快反应速度;
②如果测量氧气体积,连接顺序是:a→b→c→d,F装置内应该b管短c管长,如图 ;
;
③解:设生成氧气的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
245 96
12.25g x
$\frac{245}{12.25g}$=$\frac{96}{x}$,
x=4.8g,
答:生成氧气的质量是4.8g
④如果实际测得氧气的体积大于理论值,原因可能是未冷却到室温就读数,气体体积受热造成的.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)红色;(3)①做催化剂;② ;③2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,、122.5、4.8;④未冷却到室温就读数.
;③2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,、122.5、4.8;④未冷却到室温就读数.
点评 本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,要总体把握,本考点主要出现在实验题中.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案| A. | 日常生活中可用肥皂水鉴别硬水和软水 | |
| B. | 向酸性土壤里撒熟石灰,可调节土壤的pH | |
| C. | 铝比铁具有更好的抗腐蚀性能,是因为铁比铝更活泼 | |
| D. | 用汽油、加了洗涤剂的水分别除去衣服上的油污,两者去污原理不同 |
 如图是元素周期表中汞元素的相关信息,下列说法错误的是( )
如图是元素周期表中汞元素的相关信息,下列说法错误的是( )| A. | 汞属于非金属元素 | B. | 汞的原子序数是80 | ||
| C. | 汞原子的质子数是80 | D. | 汞的相对原子质量是200.6 |
| A. | 用灼烧的方法鉴别羊毛和合成纤维 | |
| B. | 用盐酸鉴别氢氧化钠是否变质 | |
| C. | 用石灰水区别氧气和二氧化碳 | |
| D. | 用观察颜色的方法鉴别氧化铜和四氧化三铁 |
| A. | 属于无机物 | |
| B. | 由7个碳原子、10个氢原子和5个氧原子组成 | |
| C. | 莽草酸水溶液呈酸性 | |
| D. | 莽草酸完全燃烧,产物不仅有CO2和H2O,还可能有SO2 |
 如图是测定空气中氧气含量实验的改进装置.
如图是测定空气中氧气含量实验的改进装置.