题目内容
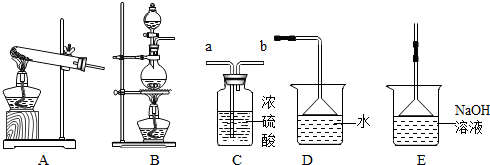
3. 如图是测定空气中氧气含量实验的改进装置.
如图是测定空气中氧气含量实验的改进装置.(1)图中反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)放大镜的作用是将太阳光会聚于焦点(白磷)处,使温度达到白磷的着火点.
(3)改进后实验的优点是操作简便,无污染,提高了测定数据的准确性(答出一条即可).
分析 (1)根据红磷燃烧生成了五氧化二磷测解答;
(2)根据用放大镜将太阳光会聚于焦点(白磷)处,使温度达到白磷的着火点解答;
(3)根据改进后容器始终是密封的特点来分析.根据测定空气中氧气含量实验的原理、注意事项、反应的特点分析回答.
解答 解:(1)该实验的化学反应是红磷燃烧生成了五氧化二磷,方程式是:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(2)白磷着火点低,用放大镜将太阳光会聚于焦点(白磷)处,使温度达到白磷的着火点;
(3)图中的装置始终密封,操作简便,没有污染,提高了测定数据的准确度.
故答案为:
(1)4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(2)将太阳光会聚于焦点(白磷)处;
(3)操作简便,无污染,提高了测定数据的准确性.
点评 本题的难度不大,熟悉测定空气中氧气含量实验的原理、注意事项等知识即可分析解答.

练习册系列答案
相关题目
15.有X、Y、Z三种金属,把足量X放入Y(NO3)2和Z(NO3)2的混合溶液中,充分反应后过滤,滤渣中只有X、Z.据此判断这三种金属的活动性由强到弱的顺序为( )
| A. | Y>X>Z | B. | Y>Z>X | C. | X>Y>Z | D. | X>Z>Y |
13.把足量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体,在反应过程中,溶液的温度也先随之升高,最后下降到室温.于是,同学们设计实验来探究“一定质量的锌粒和同体积盐酸反应快慢的影响因素”.
测得实验数据如表:
一定质量的锌粒与同体积盐酸溶液反应实验数据表
(1)锌粒和盐酸反应的化学化学方程式为Zn+2HCl═ZnCl2+H2↑.
(2)分析实验数据得出:一定质量的锌粒和同体积盐酸反应,影响反应快慢的主要因素有盐酸溶液浓度、反应时溶液温度.
(3)可以通过比较哪些数据来确定锌和酸反应的快慢反应开始到2分钟产生的气体体积(或相同时间内产生的气体体积).
(4)过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快原因金属锌和盐酸反应放出热量,加快反应速率.
测得实验数据如表:
一定质量的锌粒与同体积盐酸溶液反应实验数据表
| 盐酸溶液 浓度 | 反应开始时酸溶液的 温度 | 反应开始到2分钟产生的 气体体积 | 反应结束共产生 气体体积 |
| 5% | 20℃ | 10mL | 60mL |
| 10% | 20℃ | 19mL | 118mL |
| 15% | 20℃ | 28mL | 175mL |
| 5% | 35℃ | 28mL | 60mL |
| 10% | 35℃ | 72mL | 118mL |
| 15% | 35℃ | 102mL | 175mL |
(2)分析实验数据得出:一定质量的锌粒和同体积盐酸反应,影响反应快慢的主要因素有盐酸溶液浓度、反应时溶液温度.
(3)可以通过比较哪些数据来确定锌和酸反应的快慢反应开始到2分钟产生的气体体积(或相同时间内产生的气体体积).
(4)过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快原因金属锌和盐酸反应放出热量,加快反应速率.

 如图为金宝农尿素的包装袋,根据包装袋信息计算这种肥料的最低纯度为98.57%.(计算结果精确到0.01%)提示:尿素化学式:CO(NH2)2.
如图为金宝农尿素的包装袋,根据包装袋信息计算这种肥料的最低纯度为98.57%.(计算结果精确到0.01%)提示:尿素化学式:CO(NH2)2.