题目内容
9.金属在生产和生活中有广泛的应用.
(1)如图1金属制品的用途,利用金属导电性的是B,(填字母序号);铁锅易锈蚀的原因是铁与水和氧气发生反应.
(2)早在西汉时期,人们常采用“湿法炼钢”的方法.如将铁浸入硫酸铜溶液中,该反应化学方程式Fe+CuSO4=FeSO4+Cu;其基本反应类型为置换反应.此反应过程中,溶液中增加的离子是Fe2+(填离子符号).
(3 )为验证铁、锌、铜三种金属活动性顺序,某化学兴趣小组设计了如图2所示三个实验,其中不必进行的是B(填字母序号)
(4)某电镀厂排放的污水中含有硫酸亚铁和硫酸铜,某化学兴趣小组将一定量的锌粉加入到一定量的该污水中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.滤渣和滤液中一定含有的物质是铜、铁;ZnSO4.
分析 根据金属的性质解答,铁在与水和氧气并存时易生锈;铁能与硫酸铜反应生成硫酸亚铁和铜,硫酸亚铁中含有的金属阳离子是亚铁离子,根据金属活动性顺序确定实验方案和实验的结果.
解答 解:(1)图中金属制品的用途,利用金属导电性的是导线;铁锅易锈蚀的原因是铁与水和氧气发生反应,故填:B,与水和氧气并存.
(2)将铁浸人硫酸铜溶液中,二者会反应生成硫酸亚铁和铜,该反应是置换反应,增加的离子是亚铁离子,故填:Fe+CuSO4=FeSO4+Cu; 置换反应.Fe2+.
(3 )为验证铁、锌、铜三种金属活动性顺序,A实验能证明锌的活动性大于铁,C实验能证明铁的活动性大于铜,故其中不必进行的是实验B,故填:B;
(4)污水中含有硫酸亚铁和硫酸铜,将一定量的锌粉加入到一定量的该污水中,则锌首先与硫酸铜反应生成硫酸锌和铜,然后锌与硫酸亚铁反应生成硫酸锌和铁,充分反应后过滤,向滤渣中加人盐酸,有气泡产生,说明一定含有金属铁,故一定含有铜,滤液中一定含有硫酸锌,一定不含有硫酸铜,可能含有硫酸亚铁,故填铜、铁;ZnSO4.
点评 本题考查的是金属活动性顺序的应用,完成此题,可以依据已有的金属活动性顺序的意义进行.

练习册系列答案
相关题目
19. 在Cu+的作用下可将乙烯(C2H4)和烟气混合除去其中的二氧化硫,其反应过程如图所示,下列说法错误的是( )
在Cu+的作用下可将乙烯(C2H4)和烟气混合除去其中的二氧化硫,其反应过程如图所示,下列说法错误的是( )
 在Cu+的作用下可将乙烯(C2H4)和烟气混合除去其中的二氧化硫,其反应过程如图所示,下列说法错误的是( )
在Cu+的作用下可将乙烯(C2H4)和烟气混合除去其中的二氧化硫,其反应过程如图所示,下列说法错误的是( )| A. | Cu+在反应中其催化作用 | |
| B. | 该反应属于化合反应 | |
| C. | 反应前后氧原子的个数没有发生改变 | |
| D. | 利用该反应可减少酸雨的危害 |
4.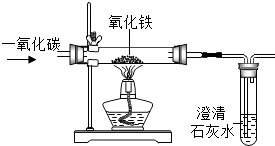 实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )
实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )
 实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )
实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )| A. | 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 | |
| B. | 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 | |
| C. | 反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 | |
| D. | 为了减少空气污染,应增加尾气处理装置 |
1.下列制备物质的设计中,理论上正确的、操作上可行、经济上合理的是( )
| A. | CO$→_{△}^{CuO}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3溶液 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2溶液 | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{稀硫酸}{→}$Fe(S04)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}溶液}{→}$NaOH 溶液 |
8.小强同学很喜欢学习化学.他将1.2g镁放入装有50g稀硫酸的烧杯中,恰好完全反应.现请你和他一起计算:
(1)反应后生成氢气的质量.
(2)反应前稀硫酸的溶质质量分数.
(3)反应后所得溶液的质量分数.
(1)反应后生成氢气的质量.
(2)反应前稀硫酸的溶质质量分数.
(3)反应后所得溶液的质量分数.
6.美国(自然)杂志报道,科学家在研究地下水时发现,处于地下深处两个矿物层中的水,由于受到高压的作用变成了类似“果冻”态的胶状体,呈仅几个分子厚度的水膜,黏度也大为增加,下列关于“果冻水”的说法中正确的是( )
| A. | 果冻水不属于氧化物 | B. | 果冻水中水分子不运动 | ||
| C. | 果冻水和普通水的化学性质相同 | D. | 果冻水与普通水物理性质相同 |
 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡.
铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡. A、B、C、D、E是初中常见的五种物质,其中 D是黑色固体,且与C在一定条件下反应有红色物质生成,E的固体俗称干冰.①、②、③、④的反应类型分别是复分解反应、分解反应、化合反应和置换反应.图中“一”表示两端物质间能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去.
A、B、C、D、E是初中常见的五种物质,其中 D是黑色固体,且与C在一定条件下反应有红色物质生成,E的固体俗称干冰.①、②、③、④的反应类型分别是复分解反应、分解反应、化合反应和置换反应.图中“一”表示两端物质间能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去.