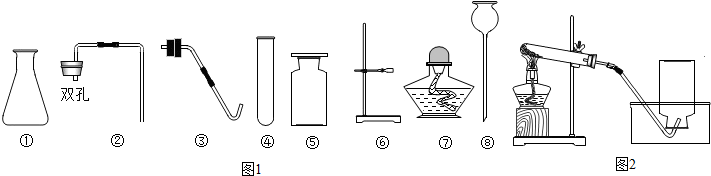
题目内容
8.小强同学很喜欢学习化学.他将1.2g镁放入装有50g稀硫酸的烧杯中,恰好完全反应.现请你和他一起计算:(1)反应后生成氢气的质量.
(2)反应前稀硫酸的溶质质量分数.
(3)反应后所得溶液的质量分数.
分析 镁与稀硫酸反应生成硫酸镁和氢气;根据参加反应的镁的质量,由反应的化学方程式列式计算出氢气的质量和稀硫酸的溶质的质量、生成硫酸镁的质量,进而计算出溶质的质量分数.
解答 解:设反应后生成的氢气质量为x,反应前硫酸的质量为y,生成硫酸镁的质量为z
Mg+H2SO4=MgSO4+H2↑
24 98 120 2
1.2g y z x
$\frac{24}{1.2g}=\frac{98}{y}=\frac{120}{z}=\frac{2}{x}$
x=0.1g
y=4.9g
z=6g
反应前稀硫酸的溶质质量分数=$\frac{4.9g}{50g}×$100%=9.8%;
反应后所得溶液的质量分数=$\frac{6g}{1.2g+50g-0.1g}×$100%=11.7%
答案:
(1)反应后生成氢气的质量为0.1g;
(2)反应前稀硫酸的溶质质量分数为9.8%;
(3)反应后所得溶液的质量分数为11.7%.
点评 化学方程式可表示反应中各物质质量关系,利用反应中各物质的质量关系,由其中任意一物质的质量都可计算出反应中其它物质的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.化学学习让我们有了很多收获,下列归纳总结完全正确的一组是( )
| A、实验中的先与后 | B、健康生活 |
| ①检验装置气密性-先把导管放入水,后用手加热 ②给试管中物质加热-先预热,后用外焰固定加热 ③加热高锰酸钾制氧气并用排水法收集实验结束 时-先熄灭酒精灯,后把导管移出水面 | ①合理营养,平衡膳食 ②不过量饮用碳酸饮料 ③不购买和食用过期食品 |
| C、合理利用资源 | D、实验安全 |
| ①钢铁表面上刷上油漆,防止钢铁生锈 ②大量使用农药,化肥提高农业产量 ③生活中使用塑料袋非常方便,可随意使用 | ①危险实验佩戴防护眼镜 ②鉴别有些化学试剂时可以品尝 ③点燃可燃性气体前一定要验纯 |
| A. | A | B. | B | C. | C | D. | D |
17.如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图,下列说法正确的是( )
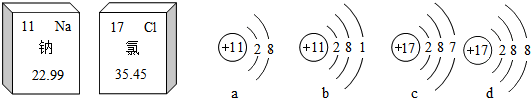
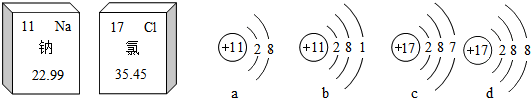
| A. | 钠、氯都属于金属元素 | B. | a表示的是一种阴离子 | ||
| C. | 氯的相对原子质量是35.45g | D. | 氯化钠是由a、d两种粒子构成的 |
18.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是( )
| A. | (NH4)2HPO4 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | KNO3 |

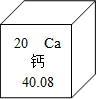 钙元素对人类生命和生活具有重要意义.
钙元素对人类生命和生活具有重要意义.