题目内容
8.某NaHCO3样品中含有少量氯化钠.化学兴趣小组的同学为了测定该样品中NaHCO3的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.测得的有关数据如下表所示.试计算:(计算结果保留一位小数)
| 物质 | 样品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
(2)反应后所得溶液中NaCl的质量分数.
分析 根据质量守恒定律可知,反应前后的质量变化就是因为生成了二氧化碳,所以可求二氧化碳的质量,进而结合二氧化碳的质量和对应的化学方程式求算碳酸氢钠的质量和生成的氯化钠的质量,然后求算所得溶液中氯化钠的 质量分数.
解答 解:根据质量守恒定律可知,生成的二氧化碳的质量为9g+75.4g-80g=4.4g
设生成二氧化碳4.4g消耗的碳酸氢钠的质量为x,生成的氯化钠的质量为y
NaHCO3+HCl═NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g
$\frac{84}{x}$=$\frac{58.5}{y}$=$\frac{44}{4.4g}$
x=8.4g
y=5.85g
则原样品中氯化钠的质量为9g-8.4g=0.6g
则所得溶液中氯化钠的质量为0.6g+5.85g=6.45g
则所得溶液中氯化钠的质量分数为$\frac{6.45g}{80g}$×100%≈8.1%
答:(1)样品中NaHCO3的质量是 8.4g;
(2)反应后所得溶液中NaCl的质量分数为8.1%.
点评 根据质量守恒定律计算首先要确定计算所需要的数据,同时需要确定多少数据需要借助该反应的化学方程式一次性求算出来.

| A. | 一定含有碳、氢两种元素 | |
| B. | 一定含有碳、氢元素,可能含有氧元素 | |
| C. | 一定含有碳、氢、氧三种元素 | |
| D. | 只含有碳元素 |
| A. |  熄灭酒精灯 | B. |  倾倒液体 | ||
| C. |  量取液体 | D. |  过滤 过滤粗食盐水 |
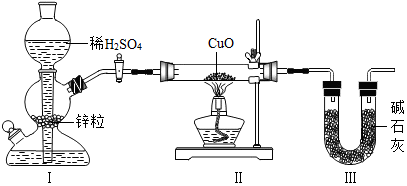 用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )| A. | I、Ⅱ装置之间缺少干燥装置 | |
| B. | III 装置干燥剂量不足,水没有被完全吸收 | |
| C. | CuO 没有全部被还原 | |
| D. | Ⅱ装置中玻璃管内有水冷凝 |
以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图。
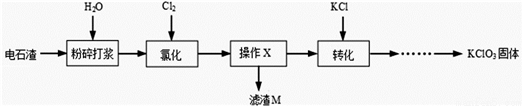
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6 Ca(OH)2 + 6 Cl2 = Ca(ClO3)2 + 5CaCl2 + aH2O
(1)氯化前,先将电石渣粉碎的目的是___________。
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为_______________价,a数值为___________。
(3)操作X为______________。转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为_____________。(相关物质的溶解度见下图)
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③___________。
【实验验证】
实验步骤 | 实验现象 | 结论 |
步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入_______; | 观察到___________现象 | 猜想①不正确 |
步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到___________现象 | 猜想③正确 |