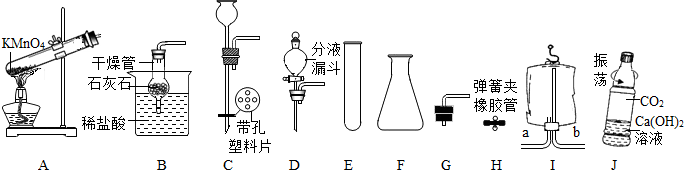
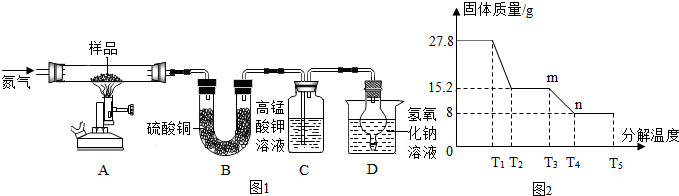
题目内容
4.有一包黑色粉末由氧化铜和炭粉混合而成,将其装入试管中加热,充分反应后,黑色氧化铜全部转化为红色的铜,称剩余固体质量,发现减轻了4.4g.(C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑)则:(1)根据质量守恒定律,可知生成二氧化碳4.4克.
(2)求混合物中氧化铜的质量.
分析 根据氧化铜和炭粉在高温的条件下生成铜和二氧化碳,固体减少的质量就是生成二氧化碳的质量进行计算.
解答 解:(1)根据质量守恒定律,可知固体减少的质量就是生成二氧化碳的质量就是4.4g;
(2)设混合物中氧化铜的质量是x
C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
160 44
x 4.4g
$\frac{160}{x}$=$\frac{44}{4.4g}$
x=16g
故答案为:(1)4.4;
(2)混合物中氧化铜的质量是16g.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12. 砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
 砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )| A. | 属于非金属元素 | B. | 原子的核内质子数是31 | ||
| C. | 原子的核内中子数是31 | D. | 1个镓原子的质量为69.72g |