题目内容
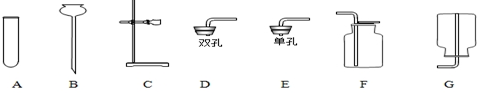
9.请你结合下列装置图回答问题.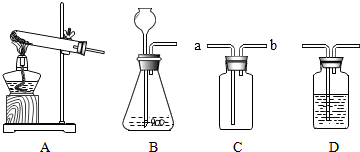
(1)选写出图中一种玻璃仪器的名称:试管.
(2)可用来制取O2、CO2和H2的发生装置是B(填字母).若实验室用该装置来制取O2,写出反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)已知SO2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大.则SO2不能(填“能”或“不能”)用排水法收集:若用装置C收集SO2气体,进气口为a(填“a”或“b”);为避免SO2对环境的污染,常用装置D装NaOH溶液来吸收,该反应的化学方程式是:SO2+2NaOH=Na2SO3+H2O.
(4)生活、生产中煤的燃烧也会产生SO2污染环境,下列环境问题与燃烧煤有直接关系的是ABD(填序号).
A、酸雨 B、温室效应 C、臭氧层破坏 D、可吸入颗粒物增加.
分析 (1)依据实验室常用仪器的认识解决此题;
(2)装置B是不需要加热的仪器,如果用双氧水制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气;在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;实验室是用锌粒和稀硫酸在常温下反应制氢气;所以实验室中既可以用来制取O2,又可以用来制取H2和CO2;
(3)根据二氧化硫密度和溶解性选择收集装置;,二氧化硫和氢氧化钠反应生成亚硫酸钠和水;
(4)根据燃煤燃烧的生成物有二氧化碳、一氧化碳、二氧化硫、二氧化氮等,由它们对环境的影响进行分析解答.
解答 解:(1)依据实验室常用仪器的认识解决此题.答案为:试管、长颈漏斗、集气瓶等;
(2)装置B是不需要加热的仪器,如果用双氧水制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气;在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;实验室是用锌粒和稀硫酸在常温下反应制氢气;所以实验室中既可以用来制取O2,又可以用来制取H2和CO2,故答案为:B;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)SO2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,不能用排水法收集:若用装置C收集SO2气体,因为SO2的密度比空气大,进气口为a;二氧化硫和氢氧化钠反应生成亚硫酸钠和水,该反应的化学方程式是:SO2+2NaOH=Na2SO3+H2O;
(4)A、燃煤燃烧产生的二氧化硫、二氧化氮等是形成酸雨的主要物质,与燃煤有直接关系,故选项正确.
B、燃煤燃烧产生的二氧化碳是造成温室效应的主要气体,与燃煤有直接关系,故选项正确.
C、氟氯烃对臭氧层有很大的破坏作用,会使臭氧层形成空洞,与燃煤没有直接关系,故选项错误.
D、燃煤燃烧产生的可吸入颗粒物,与燃煤有直接关系,故选项正确.
答案:
(1)试管;
(2)B;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)不能;a;SO2+2NaOH=Na2SO3+H2O;
(4)ABD.
点评 本题考查了学生对实验室制取气体的相关知识的掌握和应用能力,解答时要细心分析.能较好的考查学生应用知识解决问题的能力,明确装置选取方法,反应原理,计算等知识才能顺利解答.

 名校课堂系列答案
名校课堂系列答案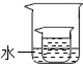 下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
下列数据是硝酸钾和氯化钠在不同温度时的溶解度.| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
(2)从NaCl溶液中得到NaCl晶体的方法是蒸发结晶;
(3)40℃时,氯化钠的溶解度小于(填“无法确定”、“大于”、“小于”)硝酸钾的溶解度;
(4)如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液.若将少量的下列物质,分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是AC(填字母).
A.冰 B.浓硫酸 C.硝酸铵 D.氢氧化钠.
| A. | 寻找新的催化剂使水变成油 | |
| B. | 测定空气中氧气含量的实验,用白磷代替红磷 | |
| C. | 用燃着的木条检验二氧化碳 | |
| D. | 通过加高烟囱排放工业废气,防止空气污染 |
| A. | (NH4)2SO4 | B. | KNO3 | C. | Ca3(PO4)2 | D. | KCl |
| A. |  钛合金表链 | B. |  紫砂壶 | C. |  塑料保鲜盒 | D. |  真丝围巾 |
| A. | N2O | B. | N2O4 | C. | NO2 | D. | NO |