题目内容
14.氯酸钾和二氧化锰共热制取氧气,已知反应前混合物共15.5克,完全反应后剩余固体10.7克,问分解出氧气多少克?剩余固体混合物中二氧化锰多少克?分析 反应前后固体质量差即为生成氧气的质量,根据氧气的质量利用化学方程式求出氯化钾或氯酸钾的质量,然后求出二氧化锰的质量.
解答 解:根据质量守恒定律氧气质量为15.5g-10.7g=4.8g.
设氯化钾的质量为x.或设氯酸钾的质量为y.
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 149 96
y x 4.8g
则$\frac{149}{96}=\frac{x}{4.8g}$,或$\frac{245}{96}=\frac{y}{4.8g}$解之得:x=7.45g,y=12.25g.
所以二氧化锰质量为10.7g-7.45g=3.25g.
或15.5g-12.25g=3.25g.
答:分解出4.8g氧气,剩余固体混合物中二氧化锰为3.25g.
点评 根据化学方程式进行计算,关键步骤要规范,一般步骤为设出未知数,写出配平的化学方程式,标出相关物质的质量比,列出比例式,求解,答,共六步.

练习册系列答案
相关题目
2. 同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.
同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.
【推理假设】上述两种物质发生反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】
(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图甲所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.
②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生,确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
(4)拓展运用:
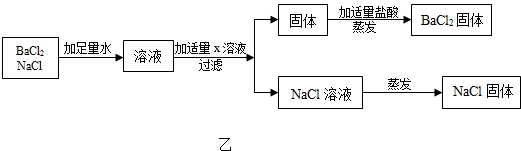
按图乙方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是Na2CO3.
 同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.
同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.【推理假设】上述两种物质发生反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】
(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图甲所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.
②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生,确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是:引进新杂质 |
| 二 | 稍过量的盐酸 | 蒸发结晶 | 可行 |
按图乙方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是Na2CO3.

9.下列物质中不能与CO2发生反应的是( )
| A. | 灼热的焦炭 | B. | 石蕊试液 | C. | 澄清的石灰水 | D. | 一氧化碳 |
19.已知化学方程式:2N2H4+X═3N2+4H2O,根据质量守恒定律,推断氧化剂的X的化学式为( )
| A. | N2O | B. | N2O4 | C. | NO2 | D. | NO |
