题目内容
10.泉州是一座古老而又美丽的滨海城市,拥有着丰富的海洋资源.(1)海水晒盐:
①将海水蒸发是利用氯化钠的溶解度受温度的影响不大(填“不大”或“较大”)的原理.
②粗盐中含有大量的泥沙等杂质,将粗盐提纯需进行的步骤为溶解、过滤(填操作名称)、蒸发结晶.
③日常生活中食盐的用途可用作调味剂(写一个).
(2)海水制碱:
①制烧碱:氯碱厂通过电解食盐水获得烧碱,该反应的化学方程式
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+X↑.X的化学式是H2.
②制纯碱:先将食盐水通过反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3分解制得纯碱,同时产生二氧化碳和水.写出NaHCO3分解制得纯碱的化学反应方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
分析 (1)①根据氯化钠的溶解度受温度变化影响不大进行分析;
②粗盐提纯的步骤进行分析即可;
③根据食盐具有咸味,可用作调味剂进行分析.
(2)①根据质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式;
②根据碳酸氢钠受热分解生成碳酸钠、水和二氧化碳写出化学方程式即可.
解答 解:(1)①氯化钠的溶解度随温度变化不大,海水晒盐主要利用蒸发水使氯化钠不断析出;
②粗盐提纯是通过溶解把不溶物与食盐初步分离,过滤把不溶物彻底除去,蒸发把食盐从溶液中分离出来而得到食盐的过程,其操作顺序应为溶解-过滤-蒸发;
③食盐具有咸味,可用作调味剂;
(2)①根据反应的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+X↑,反应物中钠、氯、氢、氧原子个数分别为2、2、4、2,反应后的生成物中钠、氯、氢、氧原子个数分别为2、2、2、2、1,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子构成,则物质X的化学式为H2;
②碳酸氢钠(NaHCO3)受热分解生成碳酸钠、水和二氧化碳,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故答案为:(1)①不大;②过滤;③可用作调味剂;(2)①H2;②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题考查的是海洋资源的利用以及有关物质的制取的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
20.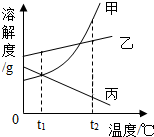 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )| A. | t1℃时,甲、丙两种物质的溶液中溶质的质量分数一定相等 | |
| B. | 将t2℃三种物质的饱和溶液降到t1℃,析出甲的质量一定比乙多 | |
| C. | 将t2℃时三种物质的饱和溶液恒温蒸发等量水后析出溶质的质量由大到小的顺序为:丙>乙>甲 | |
| D. | 将t2℃时三种物质的饱和溶液温度降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>甲>丙 |
1.下表是硝酸钾和氯化铵在不同温度时的溶解度.分析表中数据,回答问题.
(1)上述图1中,甲可表示硝酸钾的溶解度曲线.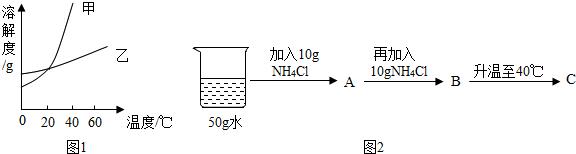
(2)60℃时,两种物质的饱和溶液中,溶质质量分数较小的是氯化铵.
(3)20℃时,按图2所示操作:B中的溶液是饱和(选填“饱和”或“不饱和”)溶液,C中溶液的溶质和溶剂质量比为2:5.(填最简整数比)
(4)20℃时,甲的饱和溶液升温至60℃(不考虑蒸发),则甲溶液溶质的质量分数将不变(填“变大”“变小”“不变”之一).
| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | |

(2)60℃时,两种物质的饱和溶液中,溶质质量分数较小的是氯化铵.
(3)20℃时,按图2所示操作:B中的溶液是饱和(选填“饱和”或“不饱和”)溶液,C中溶液的溶质和溶剂质量比为2:5.(填最简整数比)
(4)20℃时,甲的饱和溶液升温至60℃(不考虑蒸发),则甲溶液溶质的质量分数将不变(填“变大”“变小”“不变”之一).
18.下列属于物理变化的是( )
| A. | 矿石炼铁 | B. | 粮食酿酒 | C. | 金属导电 | D. | 燃放鞭炮 |
5.下列校园运动设施或器材中,没有用到有机合成材料的是( )
| A. | 铅球 | B. | 塑胶跑道 | C. | 排球 | D. | 尼龙跳绳 |
15.下列常见仪器的使用正确的是( )
| A. | 试管可以直接加热 | B. | 量筒可用作反应的容器 | ||
| C. | 温度计可用于搅拌溶液 | D. | 用燃着的酒精灯引燃另一只酒精灯 |
2.下列食物中,富含维生素的是( )
| A. | 黄瓜 | B. | 花生油 | C. | 牛肉 | D. | 米饭 |
20.除去下列各物质中的少量杂质,所选用的试剂及操作方法有错误的是( )
| 选项 | 物质 | 杂质 | 试剂及操作方法 |
| A | KNO3溶液 | KCl溶液 | 加入适量AgNO3溶液,过滤 |
| B | KClO3 | MnO2 | 加入足量水溶解,过滤、蒸发、结晶 |
| C | CO2 | CO | 将混合气体通过足量灼热的氧化铜 |
| D | 铁粉 | 铜粉 | 加入足量稀盐酸,溶解、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |