题目内容
15. 向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉的质量关系如图所示,请分析a点时溶液中含有的金属离子有哪些?(用离子符号表示),写出b-c段之间发生反应的化学方程式,试解释混合溶液的质量先减少后增加的原因.
向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉的质量关系如图所示,请分析a点时溶液中含有的金属离子有哪些?(用离子符号表示),写出b-c段之间发生反应的化学方程式,试解释混合溶液的质量先减少后增加的原因.
分析 锌比铜活泼,铜比银活泼向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,锌先和硝酸银反应,如果锌足量,则锌再和硝酸铜反应.
解答 解:锌和硝酸银、硝酸铜反应的化学方程式及其反应物、生成物之间的质量关系为:
Zn+2AgNO3=Zn(NO3)2+2Ag,Zn+Cu(NO3)2=Zn(NO3)2+Cu,
65 216 65 64
由以上质量关系可知,锌和硝酸银反应时,溶液质量减小,和硝酸铜反应时,溶液质量增大,从反应开始至b点时是锌和硝酸银反应,a点时溶液中含有的金属离子有没有反应的硝酸银中的银离子、没有反应的硝酸铜中的铜离子、锌和硝酸银反应生成的硝酸锌中的锌离子;
b-c段之间溶液的质量增大,是锌和硝酸铜反应生成硝酸锌和铜,发生反应的化学方程式为:Zn+Cu(NO3)2=Zn(NO3)2+Cu;
混合溶液的质量先减少后增加的原因是:锌先和硝酸银反应溶液质量减少,再和硝酸铜反应溶液质量增加.
故答案为:Ag2+、Cu2+、Zn2+;Zn+Cu(NO3)2=Zn(NO3)2+Cu;锌先和硝酸银反应溶液质量减少,再和硝酸铜反应溶液质量增加.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目
3.如图所示实验不能得出的信息是( )
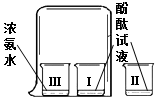

| A. | 氨水显碱性 | |
| B. | Ⅰ烧杯中酚酞变红,说明分子不断运动 | |
| C. | Ⅰ烧杯中酚酞试液变红,Ⅲ烧杯中浓氨水没有变色 | |
| D. | 温度越高,分子运动越快 |
7.将适量铜粉和镁粉的混合物放入一定量硝酸银溶液中,充分反应后过滤,得到滤渣和无色滤液.下列判断正确的是( )
| A. | 滤渣中一定含有银和铜,一定不含镁 | |
| B. | 滤渣中一定含有银,可能含有铜和镁 | |
| C. | 滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜 | |
| D. | 滤液中一定含有硝酸镁,一定没有硝酸铜和硝酸银 |



