题目内容
3.如图所示实验不能得出的信息是( )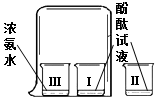
| A. | 氨水显碱性 | |
| B. | Ⅰ烧杯中酚酞变红,说明分子不断运动 | |
| C. | Ⅰ烧杯中酚酞试液变红,Ⅲ烧杯中浓氨水没有变色 | |
| D. | 温度越高,分子运动越快 |
分析 无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红;根据一段时间后,Ⅰ烧杯中酚酞变红,Ⅱ、Ⅲ烧杯中的溶液不变色,进行分析判断.
解答 解:A、一段时间后,Ⅰ烧杯中酚酞变红,是因为氨水中挥发出来的氨气溶于水形成氨水,能使酚酞变红,说明氨水显碱性,故选项说法正确.
B、Ⅰ烧杯中酚酞变红,两者没有直接接触,说明氨分子运动到了酚酞溶液中,故选项说法正确.
C、一段时间后,Ⅰ烧杯中酚酞试液变红,Ⅲ烧杯中浓氨水没有变色,故选项说法正确.
D、图示实验,温度没有变化,无法说明温度越高,分子运动越快,故选项说法错误.
故选:D.
点评 本题难度不大,掌握碱的化学性质、氨水具有挥发性、分子的基本性质等是正确解答本题的关键.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
6.生活和生产中以下说法或做法科学合理的是( )
| A. | 二氧化碳会溶于雨水形成酸雨 | B. | 洗洁精可以使油污溶于水形成溶液 | ||
| C. | 尿素[CO(NH2)2]是一种常用的复合肥料 | D. | 用熟石灰改良酸性土壤 |
3.实验室常用下列装置来制取、收集气体,仪器b是分液漏斗,可通过旋转活塞分次滴加液体.请回答以下问题:

(1)仪器a的名称是长颈漏斗.
(2)实验室用高锰酸钾制取氧气,应选用的发生装置和收集装置的组合为AF或AH (填字母序号),该发生装置的不足之处是试管口没有棉花团,该反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)实验室要制取少量CO2应选择的较简单的发生装置是E(填字母序号),某同学将生成的气体通入澄清石灰水中发现没有出现浑浊,请将可能的原因填入下表(答出一条即可),并用简单的实验进行验证.
(4)常温下块状电石(CaC2)与水反应生成乙炔(C2H2)气体和氢氧化钙,该反应的化学方程式是CaC2+2H2O=C2H2+Ca(OH)2,实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.图中适合制取乙炔气体的发生装重有CD(填装置序号).

(1)仪器a的名称是长颈漏斗.
(2)实验室用高锰酸钾制取氧气,应选用的发生装置和收集装置的组合为AF或AH (填字母序号),该发生装置的不足之处是试管口没有棉花团,该反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)实验室要制取少量CO2应选择的较简单的发生装置是E(填字母序号),某同学将生成的气体通入澄清石灰水中发现没有出现浑浊,请将可能的原因填入下表(答出一条即可),并用简单的实验进行验证.
| 可能的原因 | 实验步骤 | 实验现象 |
10. 甲、乙、丙均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
甲、乙、丙均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
 甲、乙、丙均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
甲、乙、丙均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )| A. | 若甲是金属氧化物,丙为相对分子质量最小的氧化物,则乙一定是CO2 | |
| B. | 若甲、乙、丙均为金属单质,则金属活动性甲<乙<丙 | |
| C. | 若甲、乙、丙均含有同一种元素,且丙可用来灭火,则甲一定是单质碳 | |
| D. | 甲、乙、丙之间的转化可以全部通过复分解反应实现 |
12.20℃时,在100g饱和石灰水中加入5.6g生石灰,充分搅拌后仍保持20℃,则下列叙述中正确的是( )
| A. | 有5.6g晶体析出 | B. | 石灰水中溶质的溶解度会增大 | ||
| C. | 饱和石灰水的质量会减小 | D. | 石灰水中溶质的质量分数会增大 |
13.下列离子能在pH=11的溶液中大量共存的是( )
| A. | ${CO}_{3}^{2-}$、K+、CI-、Ca2+ | B. | H+、Ba2+、${SO}_{4}^{2-}$、CI- | ||
| C. | K+、OH-、${SO}_{4}^{2-}$、Cu2+ | D. | K+、${NO}_{3}^{-}$、Na+、OH- |



 向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉的质量关系如图所示,请分析a点时溶液中含有的金属离子有哪些?(用离子符号表示),写出b-c段之间发生反应的化学方程式,试解释混合溶液的质量先减少后增加的原因.
向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉的质量关系如图所示,请分析a点时溶液中含有的金属离子有哪些?(用离子符号表示),写出b-c段之间发生反应的化学方程式,试解释混合溶液的质量先减少后增加的原因.