题目内容
9.下列实际应用中,利用中和反应原理的是( )| A. | 用氢氧化钠溶液吸收二氧化硫 | B. | 用熟石灰处理泄漏的浓硫酸 | ||
| C. | 用小苏打治疗胃酸过多 | D. | 用生石灰作食品干燥剂 |
分析 先掌握中和反应的概念:中和反应为酸和碱互相交换成分,生成盐和水的反应.则分析上面的实际应用中哪些为“酸和碱”反应;不是“酸和碱”反应,则为“不是利用中和反应原理”.
解答 解:A.氢氧化钠溶液与二氧化硫反应生成碳酸钠和水,不是酸和碱的反应,不是利用了中和反应原理.
B.氢氧化钙溶液与硫酸反应生成硫酸钙和水,是酸和碱的反应,是利用了中和反应原理.
C.碳酸氢钠是盐不是碱,与盐酸的反应不属于中和反应.
D.生石灰与水反应生成氢氧化钙,可作食品干燥剂,不是酸和碱的反应,不是利用了中和反应原理.
故选B.
点评 本题难度不大,掌握中和反应的特征(反应物必须是酸和碱,生成物必须是盐和水)是正确解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.化学兴趣小组查得资料:某品牌牙膏中的摩擦剂由碳酸钙、氢氧化铝等组成,牙膏中只有碳酸钙遇到盐酸时有气体产生.该小组对牙膏样品中碳酸钙的含量进行以下探究:
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收
(2)下列各项措施中,不能提高测定准确度的是cd(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(3)实验中准确称取8.00g样品四份,进行四次测定,每份测得BaCO3质量见表,则计算时所用BaCO3的质量为3.94g.
(4)某同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数.你是否同意此同学的观点否(填“是”或“否”),理由是B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高.
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收
(2)下列各项措施中,不能提高测定准确度的是cd(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(3)实验中准确称取8.00g样品四份,进行四次测定,每份测得BaCO3质量见表,则计算时所用BaCO3的质量为3.94g.
| BaCO3的质量/g | |
| 第一份 | 3.94 |
| 第二份 | 1.10 |
| 第三份 | 3.93 |
| 第四份 | 3.95 |
4.下列实验操作正确的是( )
| A. |  量9.0mL液体 | B. |  闻气味 | C. |  | D. |  |
18.下列数据是硝酸钾固体在不同温度时的溶解度.
(1)60℃时,l00g水中最多能溶解硝酸钾固体110g.
(2)从上述表格信息可知,将80℃的硝酸钾饱和溶液降温到40℃,会(填“会”或“不会”)有硝酸钾晶体析出.
| 温度/℃ | O | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(2)从上述表格信息可知,将80℃的硝酸钾饱和溶液降温到40℃,会(填“会”或“不会”)有硝酸钾晶体析出.
7.反应2KMnO4+□X+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O,则下列说法正确的是( )
| A. | 该反应中,X前的化学计量系数为10 | |
| B. | X中所含元素的质量比为1:16 | |
| C. | 反应前后所有元素的化合价都变化了 | |
| D. | 该实验发生装置与实验室用高锰酸钾制氧气的发生装置相同 |
 A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去):
A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去):
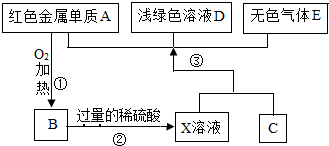 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答: