题目内容
9.海洋是地球上最大的储水库,浩瀚的海洋蕴藏着丰富的化学资源.(1)目前世界上60%的镁是从海水中提取的.其主要步骤如下:
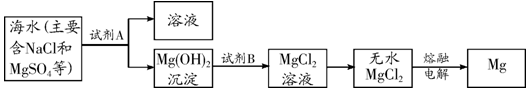
①提取Mg的过程中,试剂A可以选用氢氧化钙,由无水MgCl2制取Mg的反应类型为分解反应.
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量Na2CO3溶液的目的是除去氯化钙和过量的氯化钡.
(2)从海水中制得的氯化钠除食用外,还常用作工业原料生产相应的化工产品,如工业上利用氯化钠和水在通电条件下生成烧碱、氢气和氯气,试写出上述化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
分析 (1)氢氧化钙和硫酸镁反应生成氢氧化镁沉淀和硫酸钙;
电解氯化镁生成镁和氯气;
氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氯化钡反应生成碳酸钡沉淀和氯化钠;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.
解答 解:(1)①提取Mg的过程中,试剂A可以选用氢氧化钙,这是因为氢氧化钙和硫酸镁反应生成氢氧化镁沉淀和硫酸钙;
电解氯化镁生成镁和氯气,属于分解反应.
故填:氢氧化钙;分解反应.
②实验中加入过量Na2CO3溶液的目的是除去氯化钙和过量的氯化钡.
故填:除去氯化钙和过量的氯化钡.
(2)利用氯化钠和水在通电条件下生成烧碱、氢气和氯气,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
故填:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
19.小车剧烈冲撞后,安全气囊中会瞬间产生一种空气中含量最多的气体.该气体为( )
| A. | 氧气 | B. | 氮气 | C. | 二氧化碳 | D. | 水蒸气 |
20.现有三瓶无色液体:只知道它们是石灰水、蒸馏水、稀盐酸,为了鉴别它们,随意编号A、B、C,并进行以下实验,请你完成实验报告:
| 实验步骤 | 现象 | 结论 |
| 1、分别取A、B、C三种待测液于三支试管中,各通入二氧化碳 | A中产生白色沉淀 B、C无明显现象 | |
| 2、在两支放有大理石的试管中,分别滴入B、C二种待测液. | C中产生气泡 B无明显现象 |
4.宣传科学揭露伪科学是我们每一个人的义务,用你所学的知识指出下列广告语正确的是( )
| A. | 本超纯水,绝对纯净,不含任何化学物质 | |
| B. | “雪山牌”矿泉水,真正的纯水 | |
| C. | 矿泉水中含有钾、钠、镁等多种微量元素,是一种健康饮料 | |
| D. | 面对河水不断被污染,我们应设法关闭所有化工厂 |
1.科学研究性学习小组用盐酸与大理石反应研究影响反应剧烈程度的因素.反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O.每次实验取用相同质量含碳酸钙60%的大理石若干克,并分别滴加相同体积的质量分数为9.125%、18.25%的盐酸,(假设两种盐酸的密度都为l克/毫升,大理石中杂质不与盐酸反应).
(1)小组提出假设:盐酸与大理石反应的剧烈程度与盐酸中HCl的质量分数、反应温度有关.
(2)实验设计与实施.
①实验中他们根据反应的时间来确定反应的剧烈程度.
②设置实验①和②,可探究的问题是反应物浓度对反应的剧烈程度的影响.
(1)小组提出假设:盐酸与大理石反应的剧烈程度与盐酸中HCl的质量分数、反应温度有关.
(2)实验设计与实施.
| 实验编号 | 温度/℃ | HCl的质量分数 | 完全反应的时间/秒 |
| ① | 25 | 18.25% | 160 |
| ② | 25 | 9.125% | 210 |
| ③ | 35 | 18.25% | 60 |
②设置实验①和②,可探究的问题是反应物浓度对反应的剧烈程度的影响.




