题目内容
11.现有含氧元素的质量分数为32%的氧化镁、氧化铜组成的混合物40g,与l00g硫酸溶液恰好完全反应,则该硫酸溶液中氢元素的质量分数为( )| A. | 2% | B. | 4% | C. | 10% | D. | 19.6% |
分析 根据氧化铜和稀硫酸反应生成硫酸铜和水,氧化镁和稀硫酸反应生成硫酸镁和水,再根据氧元素的质量守恒进行分析解答.
解答 解:由于氧化铜和氧化镁的混合物与100g硫酸溶液恰好完全反应,分析化学方程式CuO+H2SO4=CuSO4+H2O,MgO+H2SO4=MgSO4+H2O,可知氧化物中氧元素全部转变为水中的氧元素,生成水中氢元素全部来自硫酸即可;
氧化镁、氧化铜组成的混合物中氧元素的质量是40g×32%=12.8g,
设硫酸溶液中硫酸的质量为x,其中氢元素的质量为y,由化学方程式可以看出氧化镁、氧化铜组成的混合物中氧元素、硫酸、生成水以及氢元素的关系为
O~H2SO4~H2O~2H
16 98 2
12.8g x y
$\frac{16}{12.8g}=\frac{98}{x}=\frac{2}{y}$
x=78.4g,y=1.6g
该硫酸溶液中水的质量为100g-78.9g=21.1g,其中氢元素的质量为21.2g×$\frac{1×2}{18}×100%$=2.34g
则该硫酸溶液中氢元素的质量分数为:$\frac{1.6g+2.34g}{100g}×100%$≈4%.
故选B.
点评 本题很好的考查了质量守恒定律的应用,解答时首先分析实验的反应原理,再根据反应原理,根据化学方程式计算出该样品中某一成分的质量,得出所要探究的物质中该成分的含量.

练习册系列答案
相关题目
17.在氯化钡溶液中滴加某种溶液,生成白色沉淀.有关说法错误的是( )
| A. | 滴入的可能是硝酸盐溶液 | B. | 反应后溶液可能呈酸性 | ||
| C. | 该反应可能是中和反应 | D. | 白色沉淀可能溶于盐酸 |
14.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半.再经足量的氢氧化钠溶液吸收后,容器内几乎成真空.此碳氢化合物可能是( )(本题不考虑生成一氧化碳)
| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C3H8 |
16.某同学做了如下图所示实验并对实验数据和现象记录如下表,请回答下列问题: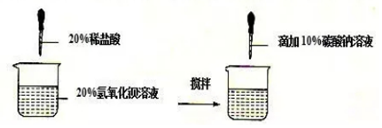
(1)写出第一次实验中加入盐酸后发生反应的化学方程式2HCl+Ba(OH)2═BaCl2+2H2O.
(2)第一次实验结束后所得溶液中溶质的化学式为NaCl和NaOH.
(3)根据已知条件求解出第二次实验生成白色沉淀X的比例式$\frac{106}{21.2g}=\frac{197}{X}$.
(4)第二次实验中每一步所加物质均恰好完全反应
(5)若向第二次的溶液中加入51.4g水,则所得不饱和溶液中溶质的质量分数为5%.
(6)若配制实验中需要的稀盐酸,需用36.5%的浓盐酸的质量为140g.

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 氢氧化钡溶液质量 | 171g | 171g | 171g |
| 滴加盐酸的质量 | 36.5g | 73g | 146g |
| 滴加碳酸钠溶液质量 | 212g | 212g | 212g |
(2)第一次实验结束后所得溶液中溶质的化学式为NaCl和NaOH.
(3)根据已知条件求解出第二次实验生成白色沉淀X的比例式$\frac{106}{21.2g}=\frac{197}{X}$.
(4)第二次实验中每一步所加物质均恰好完全反应
(5)若向第二次的溶液中加入51.4g水,则所得不饱和溶液中溶质的质量分数为5%.
(6)若配制实验中需要的稀盐酸,需用36.5%的浓盐酸的质量为140g.
20.许多化学概念在逻辑上存在着包含、并列或交叉的关系,如图所示,下列有关概念间的关系的说法正确的是( )


| A. | 酸和碱属于并列关系 | B. | 单质和化合物属于包含关系 | ||
| C. | 纯净物和混合物属于交叉关系 | D. | 燃烧和爆炸属于包含关系 |
1.下列说法错误的是( )
| A.化学与安全 | B.食品与健康 |
| ①重金属中毒-可喝鲜牛奶解毒 ②煤气泄漏-应关闭气阀,开窗通风 | ①缺锌易使幼儿患侏儒症 ②人体所需维生素量不多,但不能缺少 |
| C.中和反应 | D.方程式表示所述内容 |
| ①在酸碱中和后的溶液中滴加酚酞试液 ②在NaOH固体中滴加稀盐酸,温度升高,可证明中和反应放热 | ①酸雨形成:CO2+H2O=H2CO3 ②用Al(OH)3治疗胃酸过多:Al(OH)3+3HCl=AlCl3+3H2O |
| A. | A | B. | B | C. | C | D. | D |
 某同学对实验室制取CO2的实验进行探究.
某同学对实验室制取CO2的实验进行探究.