题目内容
3.化学是在分子、原子的水平上研究物质的组成、结构、性质及其应用的一门自然科学,如图是某化学反应的微观示意图,你认为下列说法不正确的是( )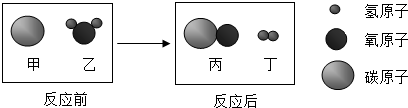
| A. | 反应前后原子的种类、数目都不变 | |
| B. | 反应前后各元素的化合价都发生了改变 | |
| C. | 乙、丙两种物质都是氧化物 | |
| D. | 该反应是置换反应 |
分析 观察化学反应的微观示意图,根据微粒的构成,分析反应物、生成物,写出反应的化学方程式,根据方程式的意义等分析判断有关的问题.
解答 解:由化学反应的微观示意图可知,该反应是碳和水在高温条件下反应生成了一氧化碳和氢气,反应的方程式是:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
A、由微粒的变化可知,反应前后原子的种类、数目都不变.故A正确;
B、由元素的化合价可知,在反应前后氧元素的化合价没有发生变化,故错误;
C、乙、丙两种物质分别是水和一氧化碳,都是氧化物,故正确;
D、该反应由一种单质与一种化合物反应,生成了另一种单质和另一种化合物,属于置换反应,故D正确.
故选B.
点评 本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键.

练习册系列答案
相关题目
14.下列生活中的变化,属于物理变化的是( )
| A. | 铁钉生锈 | B. | 蜡烛燃烧 | C. | 食物变质 | D. | 矿石粉碎 |
11.物质的结构决定性质,下列有关说法错误的是( )
| A. | 过氧化氢与水化学性质不同的原因是由于分子构成不同 | |
| B. | 盐酸与硫酸化学性质相似的原因是在水溶液中都含有H+ | |
| C. | 金刚石和石墨的物理性质不同,是由于构成它们的碳原子不同 | |
| D. | 生铁和钢的性能不同,主要是由于其含碳量不同 |
18.某化学兴趣小组的同学们学习了纯碱的知识后,对著名的侯氏制碱法产生了浓厚的兴趣,巨鼎对侯氏制碱法进行深入的探究,请你一起参与他们的探究.
【查阅资料】
1、侯氏制碱法的原理:
第一步:向饱和食盐水中先通入过量氨气(溶液显碱性),再通入过量的二氧化碳,即可析出NaHCO3固体,反应方程式是:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl
第二步:将第一步反应后所得的混合物进行过滤后,将滤渣加热,可生成纯碱,一种能使澄清石灰水变浑浊的气体和一种常见的氧化物.
2、已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
3、已知NH4Cl 加热条件下易分解,反应的化学方程式是$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑
【资料回顾】
(1)第一步中析出NaHCO3固体的原因是:相同条件下,碳酸氢钠的溶解度比氯化钠和碳酸钠小.实验中先向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,其原因是①(填序号).
①使CO2更容易被吸收 ②NH3比CO2更易制取 ③CO2的密度比NH3大
(2)写出第二步中将滤渣加热发生反应的化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.(3)该工业同时可得副产物NH4Cl,它在农业上可作氮肥,写出NH4Cl与熟石灰固体加热的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
【定性探究】
第一步反应所得混合物在第二步过滤后所得滤液中溶质的成分是什么?
【做出猜想】猜想Ⅰ:NH4Cl 猜想Ⅱ:NH4Cl和 NaHCO3
猜想Ⅲ:NH4Cl 和NaCl 猜想Ⅳ:NH4Cl、NaCl和NaHCO3
【设计实验】
【交流讨论】小明同学认为步骤②结论不正确,他的理由是:氯化铵能和硝酸银反应生成白色沉淀氯化银.
小张为证明滤液中是否含NaCl,设计了以下方案:另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,往其中滴加足量的稀HNO3后,再滴加AgNO3溶液,产生白色沉淀.
【得出结论】猜想Ⅳ成立.
【反思评价】小张设计的方案中将滤液蒸干后充分灼烧的目的是排除氯化铵的干扰,而氯化铵受热易分解,所以另取少量滤液蒸干后充分灼烧,滴加足量的稀HNO3的作用是氯化银沉淀不溶于硝酸,往其中滴加稀HNO3酸化,说明生成的白色沉淀是氯化银,则证明猜想氯化钠存在.
【定量探究】
实际生产中得到的纯碱样品中含有少量的NaCl,国际上规定纯碱的纯度(即纯碱的质量分数)≥98.0%为合格品,同学们想判断某纯碱样品是否合格,分成四个小组,各取25克该样品全部溶解于水中,向其中加入相同溶质质量分数的CaCl2溶液,四组加入的CaCl2溶液的质量与产生的沉淀的质量关系如表.
(1)通过计算判断该纯碱样品是否是合格品?
(2)若要计算CaCl2溶液的溶质质量分数,可以选择第一、二组数据计算.
【查阅资料】
1、侯氏制碱法的原理:
第一步:向饱和食盐水中先通入过量氨气(溶液显碱性),再通入过量的二氧化碳,即可析出NaHCO3固体,反应方程式是:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl
第二步:将第一步反应后所得的混合物进行过滤后,将滤渣加热,可生成纯碱,一种能使澄清石灰水变浑浊的气体和一种常见的氧化物.
2、已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【资料回顾】
(1)第一步中析出NaHCO3固体的原因是:相同条件下,碳酸氢钠的溶解度比氯化钠和碳酸钠小.实验中先向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,其原因是①(填序号).
①使CO2更容易被吸收 ②NH3比CO2更易制取 ③CO2的密度比NH3大
(2)写出第二步中将滤渣加热发生反应的化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.(3)该工业同时可得副产物NH4Cl,它在农业上可作氮肥,写出NH4Cl与熟石灰固体加热的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
【定性探究】
第一步反应所得混合物在第二步过滤后所得滤液中溶质的成分是什么?
【做出猜想】猜想Ⅰ:NH4Cl 猜想Ⅱ:NH4Cl和 NaHCO3
猜想Ⅲ:NH4Cl 和NaCl 猜想Ⅳ:NH4Cl、NaCl和NaHCO3
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加稀盐酸 | 产生无色无味气体 | 说明滤液中含有的物质是NaHCO3 |
| ②另取少量滤液于试管中,滴加足量稀HNO3后,再滴加AgNO3溶液 | 产生白色沉淀 | 证明滤液中含有NaCl |
小张为证明滤液中是否含NaCl,设计了以下方案:另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,往其中滴加足量的稀HNO3后,再滴加AgNO3溶液,产生白色沉淀.
【得出结论】猜想Ⅳ成立.
【反思评价】小张设计的方案中将滤液蒸干后充分灼烧的目的是排除氯化铵的干扰,而氯化铵受热易分解,所以另取少量滤液蒸干后充分灼烧,滴加足量的稀HNO3的作用是氯化银沉淀不溶于硝酸,往其中滴加稀HNO3酸化,说明生成的白色沉淀是氯化银,则证明猜想氯化钠存在.
【定量探究】
实际生产中得到的纯碱样品中含有少量的NaCl,国际上规定纯碱的纯度(即纯碱的质量分数)≥98.0%为合格品,同学们想判断某纯碱样品是否合格,分成四个小组,各取25克该样品全部溶解于水中,向其中加入相同溶质质量分数的CaCl2溶液,四组加入的CaCl2溶液的质量与产生的沉淀的质量关系如表.
| 第一组 | 第二组 | 第三组 | 第四组 | |
| CaCl2溶液的质量(克) | 100 | 200 | 300 | 400 |
| 产生沉淀的质量(克) | 8 | 16 | 20 | 20 |
(2)若要计算CaCl2溶液的溶质质量分数,可以选择第一、二组数据计算.
15.下列实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向氢氧化钠固体中加入水 | 氢氧化钠固体消失 | 氢氧化钠与水发生了化学反应 |
| B | 向含有硝酸银、硝酸铜、硝酸锌的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀盐酸 | 有气泡产生 | 滤液中一定含有Zn2+、Fe3+、可能有Cu2+ |
| C | 向溶质的质量分数为5%的过氧化氢溶液中加入少量氧化铜 | 有大量气泡产生 | 氧化铜起催化作用 |
| D | 向盐酸和氢氧化钙反应后的溶液中滴加酚酞 | 无明显现象 | 说明盐酸和氢氧化钙恰好反应 |
| A. | A | B. | B | C. | C | D. | D |
12.食用下列食品,通常不会对人体健康造成危害的是( )
| A. | 用甲醛溶液浸泡海鲜品 | B. | 用工业盐腌制咸鱼腊肉 | ||
| C. | 牛奶经发酵后得到酸奶 | D. | 用聚氯乙烯塑料袋包装食品 |
