��Ŀ����
14����ͼ������������������ӡ�øߵ�Fe3O4�۵IJ��ֹ������̼�ͼ��
��֪����������������Ӧ��Fe2��SO4��3+Fe�T3FeSO4
��1���Լ�X��NaOH��д��ѧʽ����
��2���������������ķ�Ӧ�Ļ�ѧ����ʽΪFe2O3+3H2SO4�TFe2��SO4��3+3H2O��
��3�������ۣ����������������м������ᣬ�����������������ᷢ����Ӧ�⣬һ��������������Ӧ�����������жϵ����������ܺ������������ᷴӦ���ɵ���������Ӧ��
��4��Fe��OH��2��Fe�Ļ��ϼ�+2��ͨ������ʱ�Ļ�ѧ����ʽ�ǣ����벹��������4Fe��OH��2+2H2O+O2�T4Fe��OH��3���ɳ������Fe3O4�Ĺ����з����ķ�ӦΪFe��OH��2+2Fe��OH��3$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2O����ˣ�ͨ������ʱ��������ơ�һ����������Ŀ���Ƿ�ֹ��������������ȫ����������������
��5��ȡ��ʵ����FeSO4��Һ100g�������еμ�������NaOH��Һ�����Fe��OH��2����������Ϊ13.5g���Լ��㣺
��FeSO4��Һ�����ʵ����������Ƕ��٣���ȷ��0.1%����
�����յõ���Ʒ��������������������ȷ��0.1��
���� ��1�������������������Ʒ�Ӧ�������������������������ƣ�
��2���������������ķ�Ӧ������������ˮ��
��3�����������������ᷴӦ������������ˮ��������������Ӧ��������������
��4����������Ԫ�ػ��ϼ۴�����Ϊ�㣻
��ѧ��Ӧǰ��Ԫ�ص�����䣬ԭ�ӵ����ࡢ�ܸ������䣻
��5�����ݷ�Ӧ�Ļ�ѧ����ʽ���ṩ�����ݿ��Խ�����ط���ļ��㣮
��� �⣺��1�������������������Ʒ�Ӧ�������������������������ƣ�����Լ�X��NaOH��
���NaOH��
��2���������������ķ�Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+3H2SO4�TFe2��SO4��3+3H2O��
���Fe2O3+3H2SO4�TFe2��SO4��3+3H2O��
��3�������ۣ����������������м������ᣬ�����������������ᷢ����Ӧ�⣬һ��������������Ӧ�����������жϵ����������ܺ������������ᷴӦ���ɵ���������Ӧ��
������ܺ������������ᷴӦ���ɵ���������Ӧ��
��4������������������Ԫ�صĻ��ϼ�Ϊx��
�����������У���Ԫ�صĻ��ϼ���+1����Ԫ�ػ��ϼ���-2�����������У�x+��-2����2+��+1����2=0��
x=+2��
�������غ㶨�ɿ�֪��ͨ������ʱ�Ļ�ѧ����ʽΪ��4Fe��OH��2+2H2O+O2�T4Fe��OH��3��
�ɳ������Fe3O4�Ĺ����з����ķ�ӦΪFe��OH��2+2Fe��OH��3$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2O����ˣ�ͨ������ʱ��������ơ�һ����������Ŀ���Ƿ�ֹ��������������ȫ����������������
���+2��H2O����ֹ��������������ȫ����������������
��5����������������Ϊy��
FeSO4+2NaOH=Na2SO4+Fe��OH��2����
152 90
y 13.5g
$\frac{152}{y}$=$\frac{90}{13.5g}$��
y=22.8g��
FeSO4��Һ�����ʵ����������ǣ�$\frac{22.8g}{100g}$��100%=22.8%��
�����յõ���Ʒ��������������Ϊz��
�ɷ�Ӧ���̿�֪�����������е���Ԫ����ȫת���������������У�
����������22.8g��$\frac{56}{152}$��100%=z��$\frac{168}{232}$��100%��
z=11.6g��
��FeSO4��Һ�����ʵ�����������22.8%�����յõ���Ʒ����������������11.6g��
���� ������Ҫ�������ʵ����ʣ����ʱҪ���ݸ������ʵ����ʣ���ϸ������������з������жϣ��Ӷ��ó���ȷ�Ľ��ۣ�

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
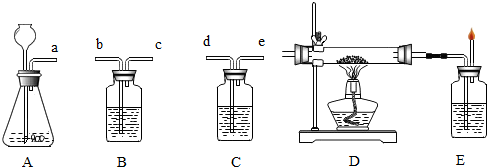
�����������ҵ�������������ϵ�д��ٽ�������ľƾ���ˮ��Ϲ۲��Ϻ���Һ����仯
����ľ̿����������īˮ
�۵�ȼ�ߵͲ�ͬ����֧����Ȼ������һ���ձ��۲�����Ϩ�����
����ʳ����������������
����Ǧ��о�ķ�ĩ�����������
����ʯ������ˮ�����¶ȱ仯��
| A�� | �٢ڢݢ� | B�� | �ۢܢ� | C�� | �٢ڢ� | D�� | �ۢ� |
| A�� |  �㵹Һ�� | B�� |  ��ȡ��Ͳ��Һ����� | ||
| C�� |  Ϩ��ƾ��� | D�� |  ���Թ��ڼӹ����ĩ |

| A�� | ̼�����ԭ������Ϊ12.01 | B�� | ��ԭ�ӵĺ��������Ϊ7 | ||
| C�� | ��Ԫ��ֻ���γ�һ�ֵ��� | D�� | C��N��O��ԭ�������������� |
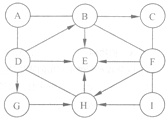 ��ͼ�е�A-I��ʾ���ֳ��л�ѧ�����Ĵ�����ҷֱ�����H��C��O��S��Cl��Na��Ca�е����ֻ���������Ԫ����ɣ�����A��E��H�������A����Ԫ����������Ϊ50%��I�׳�С�մ�C��I�ֱ�������F��Ӧ����������ͬ��ͼ�С�--����ʾ���˵��������ܷ�����ѧ��Ӧ����һ����ʾ���ʼ����ת����ϵ�����ַ�Ӧ�������������ȥ��
��ͼ�е�A-I��ʾ���ֳ��л�ѧ�����Ĵ�����ҷֱ�����H��C��O��S��Cl��Na��Ca�е����ֻ���������Ԫ����ɣ�����A��E��H�������A����Ԫ����������Ϊ50%��I�׳�С�մ�C��I�ֱ�������F��Ӧ����������ͬ��ͼ�С�--����ʾ���˵��������ܷ�����ѧ��Ӧ����һ����ʾ���ʼ����ת����ϵ�����ַ�Ӧ�������������ȥ��