题目内容
13.某化学兴趣小组查阅资料后发现,Fe2O3等金属氧化物对双氧水的分解也具有催化作用,为比较MnO2和Fe2O3两种金属氧化物对H2O2分解的催化效果,他们分别设计了如图1、图2所示的实验进行探究.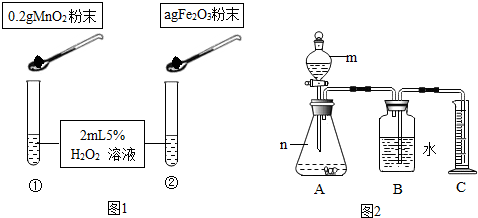
请回答下列问题:
(1)图1中a=0.2.
(2)写出图2中仪器m、n的名称:m分液漏斗,n锥形瓶.
(3)图1中试管②内发生反应的化学方程式为2H2O2$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H2O+O2↑,若需要1.6gO2,不计实验损耗,至少需要消耗68g5%的H2O2溶液.
(4)该组同学为了通过定量比较得出结论,设计如图2装置进行实验,两次实验分别在A装置中加入相同质量的MnO2和Fe2O3,两次实验中需要测量的数据是生成等体积的氧气需要的时间.
(5)实验开始前图2中B装置内已有的少量空气对气体体积的测量没有(填“有”或“没有”)影响,原因是反应后有一部氧气会存在与锥形瓶内.
分析 根据已有的知识进行分析解答,设计实验要在注意控制变量;据图即可知道仪器的名称;根据反应物和生成物书写反应的化学方程式;根据提供的数据结合化学方程式计算即可.
解答 解:(1)要比较二氧化锰和氧化铁的催化效果,需要加入的质量相等,故氧化铁的质量为0.2g,故填:0.2;
(2)据图可以看出,m是分液漏斗,n是锥形瓶,故填:分液漏斗;锥形瓶;
(3)过氧化氢在氧化铁的催化作用下分解生成水和氧气,设需要过氧化氢的质量为x
2H2O2$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H2O+O2↑
68 32
x 1.6g
$\frac{68}{32}=\frac{x}{1.6g}$
x=3.4g
故需要5%的过氧化氢溶液的质量为:3.4g÷5%=68g,故填:2H2O2$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H2O+O2↑;68;
(4)要比较催化效果,就是产生氧气速度的快慢,需要测量生成等体积的氧气需要的时间,故填:生成等体积的氧气需要的时间;
(5)装置内已有的少量空气对气体体积的测量没有影响,因为反应后有一部氧气会存在与锥形瓶内,故填:没有;反应后有一部氧气会存在与锥形瓶内.
点评 本题考查的是影响化学反应的因素,完成此题,可以依据已有的知识进行.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
4.用久置的镁条做实验时,需要用砂纸把表面的灰黑色抽打磨掉,直到露出光亮的银白色.实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究.
提出问题:镁条表面“灰黑色外衣”的成分是什么?
查阅资料:
Ⅰ.是镁与空气中的氧气反应生成的氧化镁.
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质.
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁.
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是白色的.
查阅资料:
①碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应.
②白色的硫酸铜粉末遇水能变为蓝色.
③碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O.同学们认为碳与浓硫酸反应生成三种产物的共同点是都属于氧化物(答出一点即可).
进行实验:
(1)同学们用久置的镁粉进行了如下实验.
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上.
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失.请写出有气体生成的一个反应化学方程式Mg+H2SO4═MgSO4+H2↑.
②将实验①试管中的混合物进行过滤(填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热.黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生.
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质.
实验结论:
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁.
反思与评价:
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是久置的镁条是放置在常温下的空气环境中,实验(2)是将镁粉在加热且有二氧化碳生成的环境中.
提出问题:镁条表面“灰黑色外衣”的成分是什么?
查阅资料:
Ⅰ.是镁与空气中的氧气反应生成的氧化镁.
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质.
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁.
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是白色的.
查阅资料:
①碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应.
②白色的硫酸铜粉末遇水能变为蓝色.
③碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O.同学们认为碳与浓硫酸反应生成三种产物的共同点是都属于氧化物(答出一点即可).
进行实验:
(1)同学们用久置的镁粉进行了如下实验.
实 验 装 置 |  |
| 实 验 现 象 | ①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
结 论 | 久置的镁粉中除镁元素外,还含有的元素是C、H、O 久置的镁粉中含有碱式碳酸镁 |
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失.请写出有气体生成的一个反应化学方程式Mg+H2SO4═MgSO4+H2↑.
②将实验①试管中的混合物进行过滤(填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热.黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生.
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质.
实验结论:
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁.
反思与评价:
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是久置的镁条是放置在常温下的空气环境中,实验(2)是将镁粉在加热且有二氧化碳生成的环境中.
1.密闭容器内有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,下列说法不正确的是( )
| 物质 | a | b | c | d |
| 反应前质量 | 6.40 | 3.20 | 4.00 | 0.50 |
| 反应后质量 | x | 2.56 | 7.20 | 0.50 |
| A. | d可能是催化剂 | |
| B. | 表中x为3.84 | |
| C. | c中元素的种类等于a、b两种物质中元素的种类之和 | |
| D. | 若a与b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为4:1 |
18.下列叙述正确的是( )
| A. | 有两种粒子,它们的质子总数相等、核外电子总数也相等,则它们不可能是一种分子和一种离子 | |
| B. | 氢氧化铁能使无色酚酞试液变红 | |
| C. | 不同物质其相对分子质量一定不同 | |
| D. | 两种可溶性物质通过复分解反应不可能同时得到两种沉淀 |
2.下列化学用语书写正确的是( )
| A. | 2个氮原子:N2 | B. | 2个氧分子:2O2 | C. | 1个铁离子:Fe2+ | D. | 氧化镁:MgO2 |


