题目内容
12.某实验需要100g7.6%的硫酸亚铁(FeSO4)溶液.(1)该溶液中含硫酸亚铁的质量为7.6g(精确到0.1)
(2)硫酸亚铁中硫、氧元素的质量比为1:2;
(3)实验室用硫酸亚铁晶体(化学式为FeSO4•7H2O)配制100g7.6%的硫酸亚铁溶液,需称取硫酸亚铁晶体13.9g(精确到0.1).(已知相对分子质量:FeSO4•7H2O为278,FeSO4为152)
分析 (1)根据溶质质量=溶液质量×溶质的质量分数,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)硫酸亚铁晶体(化学式为FeSO4•7H2O)溶于水,溶质是硫酸亚铁,据此结合溶质质量=溶液质量×溶质的质量分数,进行分析解答.
解答 解:(1)溶质质量=溶液质量×溶质的质量分数,100g7.6%的硫酸亚铁溶液,该溶液中含硫酸亚铁的质量为100g×7.6%=7.6g.
(2)硫酸亚铁中硫、氧元素的质量比为32:(16×4)=1:2.
(3)配制100g7.6%的硫酸亚铁溶液,需要硫酸亚铁的质量为100g×7.6%=7.6g;则需称取硫酸亚铁晶体(化学式为FeSO4•7H2O)的质量为7.6g÷($\frac{152}{278}$×100%)=13.9g.
故答案为:(1)7.6g;(2)1:2;(3)13.9.
点评 本题难度不大,掌握溶质质量=溶液质量×溶质的质量分数、化学式的有关计算是正确解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.2015年“世界水日”的主题是“水与可持续发展”.下列关于水的说法中,不正确的是( )
| A. | 硬水和软水可以用肥皂水鉴别 | |
| B. | 地球上的淡水资源是非常丰富的 | |
| C. | 生活中通过煮沸水可以降低水的硬度 | |
| D. | 水是维持人类生命和健康的营养素之一 |
7.下列各组物质中括号内物质为杂质,写出除去杂质的方程式(或方法).
| 主要物质(杂质) | 化学方程式(或方法) |
| FeSO4(CuSO4) | |
| KCl(K2CO3) | |
| KCl(K2SO4) | |
| CO2(CO) | |
| CO(CO2) | |
| NaNO3(CuSO4) | |
| KNO3(NaCl) |
17.下列实验操作中,不正确的是( )
| A. |  倾倒液体 | B. |  加热液体 | C. |  稀释浓硫酸 | D. |  检查气密性 |
1.下列属于纯净物的是( )
| A. | 铁锈 | B. | 乙醇 | C. | 加碘盐 | D. | 蛋壳 |
2.用数轴可以比较直观地表示某些科学知识.下列用数轴表示的科学知识,错误的是( )
| A. |  部分金属活动性顺序 | B. |  生物的分类等级 | ||
| C. |  部分元素的原子序数 | D. |  空气中部分成分的体积分数 |

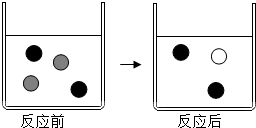 向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题:
向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题: Ag+、
Ag+、 Cu2+.
Cu2+.