题目内容
20.将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )| A. | K2CO3、BaCl2、NaOH | B. | CaC12、HCl、KNO3 | ||
| C. | KOH、HCl、(NH4)2SO4 | D. | Fe2O3、KCl、NaNO3 |
分析 根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存;本题还要注意能得到无色透明溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答 解:A、K2CO3、BaCl2反应生成碳酸钡沉淀和氯化钾,不能大量共存,故选项错误.
B、三者之间不反应,能大量共存,且不存在有色离子,符合无色透明的要求,故选项正确.
C、KOH、HCl发生中和反应生成氯化钾和水,NaOH与(NH4)2SO4反应生成硫酸钠、水和氨气,不能大量共存,故选项错误.
D、三者之间不反应,能大量共存,但FeCl3溶于水呈黄色,故选项错误.
故选:B.
点评 本题考查物质的共存问题,判断物质在溶液中能否共存,主要看溶液中的各物质之间能否发生反应生成沉淀、气体、水;还要注意特定离子的颜色.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列关于氧气的说法正确的是( )
| A. | 氧气易溶于水 | |
| B. | 食物腐败不需要氧气 | |
| C. | 硫在氧气中燃烧生成二氧化硫 | |
| D. | 氧气是一种化学性质比较活泼的气体 |
5.下列无色透明溶液,能大量共存的是( )
| A. | K+、Na+、HCO3-、OH- | B. | Cl-、MnO4-、K+、Na+ | ||
| C. | SO42-、K+、Cl-、NO3- | D. | H+、NO3-、CO32-、Fe2+ |
12.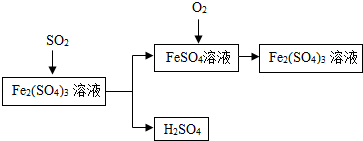 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )| A. | 该流程中可得到化工产品H2SO4 | |
| B. | 该流程中化合价发生改变的元素为Fe和S | |
| C. | 流程中涉及到的反应之一为:Fe(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 | |
| D. | 该工艺流程中Fe2(SO4)3溶液可以循环使用 |
11.氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氢气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经讨论,大家认为猜想四不合理,请用化学方程式说明原因Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
[实验验证]
[反思与拓展]
(1)若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是氢气、氨气.
(2)登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是携带安全.
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经讨论,大家认为猜想四不合理,请用化学方程式说明原因Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
[实验验证]
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | 先无变化后产生气泡 | 猜想三成立 |
(1)若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是氢气、氨气.
(2)登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是携带安全.
 人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1 004.牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.如图是某乳业公司纯牛奶包装标签上的部分文字.请仔细阅读后回答下列问题:
人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1 004.牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.如图是某乳业公司纯牛奶包装标签上的部分文字.请仔细阅读后回答下列问题: