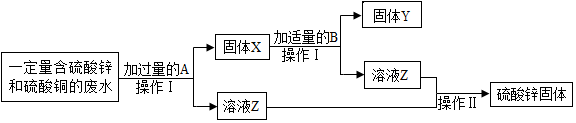
题目内容
13.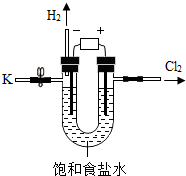 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.(提示:可以忽略其他可能发生的反应对以下实验的影响;Mg(OH)2在水中不溶)
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.(提示:可以忽略其他可能发生的反应对以下实验的影响;Mg(OH)2在水中不溶)(1)电解饱和食盐水生成烧碱、氢气和氯气,则其反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)所用食盐样品常含有泥沙、MgCl2、CaCl2和Na2SO4等杂质,电解前必须进行净化,常用的试剂有①H2O②稀盐酸③NaOH溶液④BaCl2溶液⑤Na2CO3溶液,则这些试剂正确的加入顺序是BC.
A.①②③④⑤B.①③④⑤②C.①④③⑤②D.①⑤③④②
(3)为检验待测液中已含有氢氧化钠,某同学取待测液滴加酚酞试液,当出现溶液变红现象时,表明含有氢氧化钠.
(4)为测定待测液中氢氧化钠的质量分数,可以用沉淀法.
甲组同学按如图所示的实验步骤进行实验:

A.步骤②加入的氯化镁溶液必需足量,其目的是使待测液中的氢氧化钠完全反应,滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作是:静置,取上层清液于试管中,滴加MgCl2溶液,若观察到不再产生白色沉淀现象,则证明氯化镁溶液已足量.
B.利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所得定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
(5)也可用酸碱中和测定待测液中氢氧化钠的质量分数
乙组同学称取4g的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入7.3%的稀盐酸(密度为1.02g/cm3),边加边振荡,用pH计测定溶液的pH,所得数据如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
分析 根据反应物和生成物以及反应的条件进行书写反应的化学方程式;粗盐提纯时要注意加入试剂的顺序,遵循的原则是氯化钡加在碳酸钠的前面;酚酞试液在碱性溶液中变红;加入氢氧化钠是为了除去氯化镁溶液,根据表格提供的数据结合化学方程式进行计算即可.
解答 解:(1)电解饱和食盐水生成烧碱、氢气和氯气,该反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.故填:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)加入试剂时,要先加水溶解,盐酸最后加入,注意氯化钡加在碳酸钠的前面,氢氧化钠的顺序不固定,故这些试剂正确的加入顺序可以是①③④⑤②或①④③⑤②,故填:BC.
(3)为检验待测液中已含有氢氧化钠,某同学取待测液滴加酚酞试液,当出现溶液变红现象时,表明含有氢氧化钠,故填:溶液变红.
(4)A.加入氯化镁是为了除去氢氧化钠,故步骤②加入的氯化镁溶液必需足量,滴加一定量氯化镁溶液后,要判断所加氯化镁溶液是否足量可以静置,取上层清液于试管中,滴加氯化镁溶液,若观察到不再产生白色沉淀现象,则证明氯化镁溶液已足量.故填:使待测液中的氢氧化钠完全反应; MgCl2;不再产生白色沉淀;
B.利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,则会使沉淀的质量偏大,故计算的氢氧化钠的质量偏大,故所得定氢氧化钠的质量分数将偏大,故填:偏大;
(5)设氢氧化钠的质量分数为x,则有
NaOH+HCl═NaCl+H2O
40 36.5
4g×x 9.8mL×1.02g/mL×7.3%
$\frac{40}{36.5}=\frac{4g×x}{9.8mL×1.02g/mL×7.3%}$
x=20%
答:所称取待测液中氢氧化钠的质量分数为20%.
点评 本题考查的是常见的物质的制备以及物质除杂的知识、根据化学方程式的计算的知识,完成此题,可以依据已有的知识进行.

| A. | 夏天为了更亮快,把室内空调温度设置到很低 | |
| B. | 多用煤发电少用风力发电 | |
| C. | 把还未用完的作业本烧掉 | |
| D. | 减少使用私家车次数、多乘公交车或骑自行车 |
| A. | 活性炭可除去水中的异味 | B. | 过滤可以除去水中所有的杂物 | ||
| C. | 硬水通过煮沸可降低硬度 | D. | 蒸馏对水的净化程度最高 |
| A. | 铁丝 | B. | 硫粉 | C. | 木炭 | D. | 红磷 |
| 反应前 | 反应后 |  | ||
| A | B | C | D | |
 |  |  |  | |
| A. | 4种物质均由分子构成 | B. | 反应前后各元素化合价均发生改变 | ||
| C. | 4种物质中属于氧化物的是A、B、C | D. | C、D两种物质的质量比为22:7 |
| A. | KNO3 | B. | CO(NH2)2 | ||
| C. | Ca(H2PO4)与CaSO4的混合物 | D. | K2SO4 |
 如图是A、B、C三种物质的溶解度曲线,请根据图回答:
如图是A、B、C三种物质的溶解度曲线,请根据图回答: