题目内容
19.下列说法正确的是( )| A. | 排水法收集氧气,要等导管口气泡均匀连续冒出时再开始收集 | |
| B. | 保持空气化学性质的最小粒子是空气分子 | |
| C. | 检验氢氧化钠与氯化铵反应生成的气体可用湿润的蓝色石蕊试纸 | |
| D. | 不同种元素最本质的区别是中子数不同 |
分析 A、根据用排水法收集气体时的注意事项解答;
B.根据空气是混合物分析;
C.根据氨气的检验来分析;
D.根据元素的概念来分析
解答 解:A、等到导管口气泡刚冒出就开始收集,装置中的空气混在氧气中,收集气体不纯,要等到导管口气泡均匀冒出时再收集,故说法正确;
B、空气是一种混合物,是由不同种分子构成的,没有空气分子,故说法错误;
C.氢氧化钠与氯化铵反应生成氨气,氨气的水溶液显碱性,因此检验氨气使用的是湿润的红色石蕊试纸,故说法错误;
D.元素之间的本质区别是质子数不同,故说法错误;
故选项为:A.
点评 本考点考查了气体收集、空气的组成、氨气的检验、元素的概念等,考查的知识点比较多,要加强记忆,理解应用.本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
12.下列有关分子的说法中,不正确的是( )
| A. | 分子的质量和体积都很小 | B. | 温度升高,分子的体积变大 | ||
| C. | 分子在不停地运动 | D. | 温度越高,分子运动速率越快 |
10.以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图.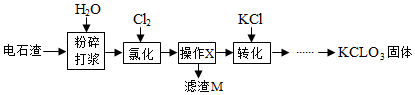
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】

查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |
14.下列四个图象中,能正确表示对应变化关系的是( )
| A. |  加热一定量氯酸钾固体 | |
| B. |  向接近饱和的硝酸钾溶液中加入硝酸钾 | |
| C. |  向一定量稀硫酸中加水 | |
| D. |  将等质量铁、锌分别与足量稀盐酸混合 |
4.烟气脱硫能有效减少二氧化硫的排放.实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究.
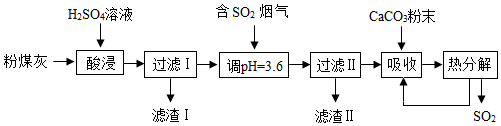
查阅资料:①SO2易溶于水,且能与水反应生成H2SO3
②+4价的硫元素具有还原性,易被氧气等物质氧化为+6硫元素
③不同溶液PH值时铝元素的存在形式如下表
(1)酸浸时使用过量的稀硫酸的目的是使氧化铝完全反应,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;滤渣Ⅰ的主要成分为SiO2(填化学式).
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x.滤渣Ⅱ的主要成分为CaSO4(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是铝离子转化为氢氧化铝而沉淀.
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是被氧气氧化为+6价成为硫酸;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将减小(填“增大”、“减小”或“不变”).

查阅资料:①SO2易溶于水,且能与水反应生成H2SO3
②+4价的硫元素具有还原性,易被氧气等物质氧化为+6硫元素
③不同溶液PH值时铝元素的存在形式如下表
| PH值 | 0-5.5 | 5.5-8 | 8-14 |
| 存在形式 | Al3+ | Al(OH)3 | AlO2- |
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x.滤渣Ⅱ的主要成分为CaSO4(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是铝离子转化为氢氧化铝而沉淀.
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是被氧气氧化为+6价成为硫酸;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将减小(填“增大”、“减小”或“不变”).
11.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-和SO${\;}_{4}^{2-}$离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
| A. | 溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、SO${\;}_{4}^{2-}$ | |
| B. | 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有Na+、OH-和SO${\;}_{4}^{2-}$ | |
| C. | 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有OH-、SO${\;}_{4}^{2-}$,可能含有Na+ | |
| D. | 溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH-、SO${\;}_{4}^{2-}$,可能含有Cl- |
8.下列有关金属材料说法正确的是( )
| A. | 铁片在海水中不易生锈 | B. | 钢是纯铁 | ||
| C. | 铝片表面易生成一层致密的氧化膜 | D. | 纯铜硬度高于黄铜(铜锌合金) |
9.汞是一种有害元素,相关信息如图所示,下列说法中正确的是( )


| A. | 原子核外有80个电子 | B. | 相对原子质量为200.6g | ||
| C. | 汞有毒,是非金属元素 | D. | 图中Y代表的是Ag |
