题目内容
1.实验室利用如图装置进行组合,制取并收集氧气及相关问题的探究.
(1)写出标注仪器的名称:a长颈漏斗,b锥形瓶.
(2)若选择A装置制取氧气,反应的文字表达式为氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气,
此时要想收集一瓶较纯净的氧气,最好选用装置C收集,实验结束后拆卸装置时应先移出导管,后熄灭酒精灯,防止水倒流,使试管炸裂.
(3)若用B、E结合来制取氧气,发生装置内反应的文字表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气
属于分解反应,此时如何证明氧气已收集满将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了.
在此过程中反应条件是二氧化锰做催化剂,它的质量和
化学性质在化学反应前后都不变.若用图2来收集氧气,氧气就从b端通入,要想测得收集到的氧气的体积,只需在装置的另一端放一量筒(填仪器名称)即可.
(4)小军同学想用稀盐酸和大理石在常温下反应制取二氧化碳,他就选择的发生装置为B,反应过程中,发现反应速度过快不好探究,于他用分液漏斗代替了仪器a很好的解决了问题.
(5)小明和小强同学用实验中产生的氧气做如下实验:
①小明做细铁丝在氧气中燃烧的实验,如图3所示,小强说小明犯了两个非常明显的错误,你认为小明所犯的错误是:集气瓶底没有水和细沙;火柴太长就放入集气瓶中.
小明改正后完成实验,他看到是现象是细铁丝剧烈燃烧,火星四射,放出大量的热,生成黑色固体,反应的文字表达式为铁+氧气$\stackrel{点燃}{→}$四氧化三铁.
②小强将产生的气体通入到图4的两支试管中,他看到热水中的白磷燃烧,冷水中的白磷不燃烧,由此他得出的可燃烧物燃烧条件是物质具有可燃性、可燃物与氧气接触、可燃物达到着火点,反应的文字表达式为磷+氧气$\stackrel{点燃}{→}$五氧化二磷.
若用乙装置完成燃烧条件的探究,与甲图相比,其缺点为污染空气,
该实验主要利用了铜片良好的导热性.燃着的白磷熄灭后,去掉铜片上的白色固体,可看到铜片表面变黑.写出铜片变黑的反应文字表达式:铜+氧气$\stackrel{加热}{→}$氧化铜.
烧杯中的水在实验中没有起到的作用是A.
A.作反应物 B.隔绝空气 C.升高温度
在表达交流的过程中,小明和小强分析了他们探究过程中的三个文字表达式,发现其有如下共同特征(写两条,合理即可):条件都是点燃、都是化合反应.
分析 长颈漏斗方便加液体药品,锥形瓶是常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净.实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂.二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;若用图2来收集氧气,氧气就从短管进入,因为氧气的密度比水小;要想测得收集到的氧气的体积,只需在装置的另一端放一量筒即可.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.小明所犯的错误是:集气瓶底没有水和细沙;火柴太长就放入集气瓶中;细铁丝在氧气中燃烧的现象是:剧烈燃烧,火星四射,放出大量的热,生成黑色固体,铁和氧气在点燃的条件下生成四氧化三铁;小强将产生的气体通入到图4的两支试管中,他看到:热水中的白磷燃烧,冷水中的白磷不燃烧,因此燃烧的条件是物质具有可燃性、可燃物与氧气接触、可燃物达到着火点;磷和氧气在点燃的条件下生成五氧化二磷;与甲图相比,乙装置的缺点为污染空气;该实验主要利用了铜片良好的导热性,铜片变黑的原因是铜的氧气在加热的条件下生成黑色的氧化铜;烧杯中的水在实验中没有起到的作用是作反应物;小明和小强分析了他们探究过程中的三个文字表达式,发现它们的共同特征是:条件都是点燃,都是化合反应,生成物都是氧化物,都是氧化反应等.
解答 解:(1)长颈漏斗方便加液体药品,锥形瓶是常用的反应容器,故答案为:长颈漏斗;锥形瓶;
(2)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净;实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂;故答案为:氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;C;先移出导管,后熄灭酒精灯;水倒流,使试管炸裂;
(3)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,属于分解反应,其中二氧化锰做催化剂;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;二氧化锰在化学反应前后的质量和化学性质不变,若用图2来收集氧气,氧气就从短管进入,因为氧气的密度比水小;要想测得收集到的氧气的体积,只需在装置的另一端放一量筒即可;故答案为:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气;属于分解反应;将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;二氧化锰做催化剂;质量;化学性质;b;量筒;
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;分液漏斗可以控制反应的速度,故答案为:B;分液漏斗;
(5)小明所犯的错误是:集气瓶底没有水和细沙;火柴太长就放入集气瓶中;细铁丝在氧气中燃烧的现象是:剧烈燃烧,火星四射,放出大量的热,生成黑色固体,铁和氧气在点燃的条件下生成四氧化三铁;小强将产生的气体通入到图4的两支试管中,他看到:热水中的白磷燃烧,冷水中的白磷不燃烧,因此燃烧的条件是物质具有可燃性、可燃物与氧气接触、可燃物达到着火点;磷和氧气在点燃的条件下生成五氧化二磷;与甲图相比,乙装置的缺点为污染空气;该实验主要利用了铜片良好的导热性,铜片变黑的原因是铜的氧气在加热的条件下生成黑色的氧化铜;烧杯中的水在实验中没有起到的作用是作反应物;小明和小强分析了他们探究过程中的三个文字表达式,发现它们的共同特征是:条件都是点燃,都是化合反应,生成物都是氧化物,都是氧化反应等;故答案为:①集气瓶底没有水和细沙;火柴太长就放入集气瓶中;火星四射;黑色固体;铁+氧气$\stackrel{点燃}{→}$四氧化三铁;②热水中的白磷燃烧,冷水中的白磷不燃烧;物质具有可燃性、可燃物与氧气接触、可燃物达到着火点;磷+氧气$\stackrel{点燃}{→}$五氧化二磷;污染空气;导热;铜+氧气$\stackrel{加热}{→}$氧化铜;A;条件都是点燃;都是化合反应;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了文字表达式的书写、气体的验满、性质和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

| 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 炭 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 29.95 |
(2)发现问题:上表格中有一种常见元素的名称错误,请改正碳,其中横线上缺的数值是15,你填写该数据的依据是从左到右质子数依次增加1;
(3)利用上表中的元素,写出一种分子构成与微粒模型“
 ”相似的物质的化学符号CO.
”相似的物质的化学符号CO. 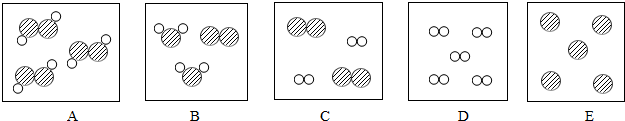
 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:

