题目内容
在实验课上,老师要同学们配制溶质质量分数为20%的氯化钠溶液50g.
(1)所需氯化钠的质量是 .
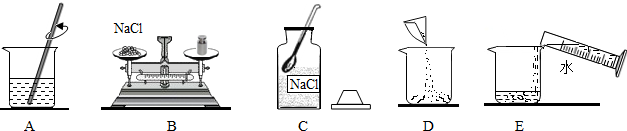
(2)主要步骤有 、 、 、装瓶保存;所需要的主要仪器有托盘天平、 、玻璃棒、 、胶头滴管、药匙、滤纸;其中玻璃棒的作用是 .
(3)下列情况可造成溶质质量分数偏低的是 .
①称量时,左盘放滤纸和氯化钠,右盘只放砝码无滤纸 ②用于溶解的烧杯内有水,未干燥
③溶解后向试剂瓶中转移时溶液洒出一部分 ④量好的水向烧杯中倒入时洒出一部分
(4)要将此溶液稀释为5%,则需加水的质量为 .
(1)所需氯化钠的质量是
(2)主要步骤有
(3)下列情况可造成溶质质量分数偏低的是
①称量时,左盘放滤纸和氯化钠,右盘只放砝码无滤纸 ②用于溶解的烧杯内有水,未干燥
③溶解后向试剂瓶中转移时溶液洒出一部分 ④量好的水向烧杯中倒入时洒出一部分
(4)要将此溶液稀释为5%,则需加水的质量为
考点:一定溶质质量分数的溶液的配制,用水稀释改变浓度的方法
专题:溶液、浊液与溶解度
分析:(1)根据溶质的质量=溶液质量×溶质质量分数进行分析;
(2)根据配制溶液所需用的仪器进行分析;
(3)根据造成溶质质量分数偏低,要从溶质质量减少和溶液质量增加的角度进行分析;
(4)根据溶液稀释前后溶质质量不变计算.
(2)根据配制溶液所需用的仪器进行分析;
(3)根据造成溶质质量分数偏低,要从溶质质量减少和溶液质量增加的角度进行分析;
(4)根据溶液稀释前后溶质质量不变计算.
解答:解:(1)所需氯化钠的质量为:50g×10%=10g;
(2)配制溶液的步骤:计算、称量、溶解、装瓶保存,所需要的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙,其中玻璃棒的作用是:搅拌,加速固体溶解;
(3)①称量时,左盘放滤纸和氯化钠,右盘只放砝码,这样称取的氯化钠在质量中多了滤纸的质量,氯化钠的实际质量减小,造成溶质质量分数偏低;②用于溶解的烧杯内有水,造成溶剂增加,配制的溶液是溶质质量分数偏低; ③溶解后向试剂瓶中转移时溶液洒出一部分,对溶质质量分数没有影响;④量好的水向烧杯中倒入时洒出一部分,会使溶剂减少,配制的溶液溶质质量分数偏高;
故选①②;
(4)根据溶液稀释前后溶质质量不变,要将此溶液稀释为5%,设需加水的质量为x,则
50g×10%=(50g+x)×5%
解得x=150g.
故答案为:(1)10g;
(2)计算,称量,溶解,量筒,玻璃棒,搅拌,加速固体溶解;
(3)①②;
(4)150g.
(2)配制溶液的步骤:计算、称量、溶解、装瓶保存,所需要的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙,其中玻璃棒的作用是:搅拌,加速固体溶解;
(3)①称量时,左盘放滤纸和氯化钠,右盘只放砝码,这样称取的氯化钠在质量中多了滤纸的质量,氯化钠的实际质量减小,造成溶质质量分数偏低;②用于溶解的烧杯内有水,造成溶剂增加,配制的溶液是溶质质量分数偏低; ③溶解后向试剂瓶中转移时溶液洒出一部分,对溶质质量分数没有影响;④量好的水向烧杯中倒入时洒出一部分,会使溶剂减少,配制的溶液溶质质量分数偏高;
故选①②;
(4)根据溶液稀释前后溶质质量不变,要将此溶液稀释为5%,设需加水的质量为x,则
50g×10%=(50g+x)×5%
解得x=150g.
故答案为:(1)10g;
(2)计算,称量,溶解,量筒,玻璃棒,搅拌,加速固体溶解;
(3)①②;
(4)150g.
点评:配制溶液常见操作:固体溶质加水溶解,配制步骤计算、称量、溶解;注意正确的操作方法和正确的使用仪器,了解错误操作对实验结果的影响.

练习册系列答案
相关题目
下列实验现象的描述错误的是( )
| A、一氧化碳在空气中燃烧产生蓝色火焰 |
| B、硫磺在空气中燃烧,发出淡蓝色火焰,且有刺激性气味气体生成 |
| C、镁带在空气中燃烧发出耀眼的白光,生成白色固体 |
| D、紫铜片在黄铜片上刻画,会看到黄铜片上留下明显的划痕 |
制取合金的方法是将两种或两种以上的金属(或金属与非金属)加热到某一温度使其全部熔化,再冷却成为合金.试根据表中的数据(其他条件均能满足)判断下列合金不宜用上述方法制取的是( )
| 金属 | Na | Mg | Al | Cu | Fe |
| 熔点(℃) | 97.5 | 649 | 660 | 1083 | 1535 |
| 沸点(℃) | 883 | 1090 | 2467 | 2567 | 2750 |
| A、Fe-Cu |
| B、Mg-Al |
| C、Al-Fe |
| D、Na-Cu |
中国科技大学科学家在440℃和高压下,利用金属钠与二氧化碳作用得到了金刚石和碳酸钠,且金刚石的颗粒有望达到宝石级大小,它将给天然金刚石开采业带来极大挑战.下列说法正确的是( )
| A、金刚石是金属单质 |
| B、碳是非金属元素 |
| C、该反应是化合反应 |
| D、该反应中生成了新的原子 |
空气是人类宝贵的自然资源,下列关于空气的说法错误的是( )
| A、空气中含有少量的稀有气体,它们可以制成多种用途的点光源 |
| B、造成空气污染的气体主要有CO、CO2和SO2等 |
| C、饼干在空气中变软是因为空气中含有水蒸气 |
| D、工业上常用分离液态空气的方法制备氮气 |