题目内容
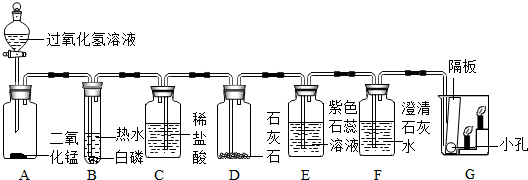
为研究草酸亚铁晶体(FeC2O4?2H2O,相对分子质量是180)分解的产物,在实验室里称取一定量的草酸亚铁晶体,利用下列装置进行实验.
①验过程中观察到B中白色无水CuSO4变色蓝色,C、F中澄清石灰水变浑浊,则E中现象是 (填实验现象).分解产物中有CO气体,还有 .
②若该实验过程中E装置内有6.4g铜生成,计算有多少物质的量的氧化铜参加了反应?(写出反应的化学方程式,列出计算步骤!)
写出方程式:
计算步骤:
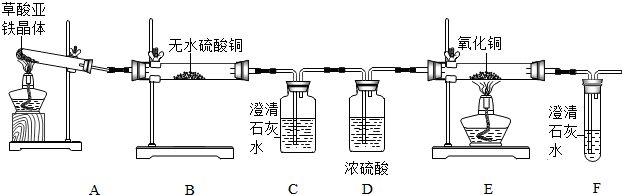
③为验证CO的性质,收集装置D后的气体于集气瓶中,将点燃的木条伸入集气瓶中(如图2),在此过程中的实验现象是 (选填编号).
A.木条熄灭 B.木条继续燃烧 C.瓶口产生淡蓝色火苗 D.发生爆炸
④进行上述实验时,先点燃A处的酒精灯,一段时间后再点燃E处的酒精灯,原因是 .
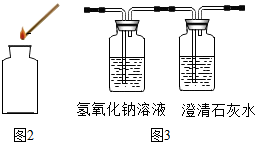
⑤若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产生物中有CO,则需在C和D装置之间增加如图3所示的洗气瓶,其中氢氧化钠溶液中发生的反应方程式是: ;
澄清石灰水起到的作用是: .

①验过程中观察到B中白色无水CuSO4变色蓝色,C、F中澄清石灰水变浑浊,则E中现象是
②若该实验过程中E装置内有6.4g铜生成,计算有多少物质的量的氧化铜参加了反应?(写出反应的化学方程式,列出计算步骤!)
写出方程式:
计算步骤:
③为验证CO的性质,收集装置D后的气体于集气瓶中,将点燃的木条伸入集气瓶中(如图2),在此过程中的实验现象是
A.木条熄灭 B.木条继续燃烧 C.瓶口产生淡蓝色火苗 D.发生爆炸

④进行上述实验时,先点燃A处的酒精灯,一段时间后再点燃E处的酒精灯,原因是
⑤若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产生物中有CO,则需在C和D装置之间增加如图3所示的洗气瓶,其中氢氧化钠溶液中发生的反应方程式是:
澄清石灰水起到的作用是:
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:科学探究
分析:①氧化铜能和还原剂发生反应;根据实验现象来分析得到的物质;
②利用化学反应方程式,将铜的质量代入计算氧化铜的物质的量.
③根据一氧化碳的性质来分析;
④可燃性气体或粉尘与氧气混合达到一定程度时,遇明火会发生爆炸;
⑤氢氧化钠溶液能够吸收二氧化碳;氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水.
②利用化学反应方程式,将铜的质量代入计算氧化铜的物质的量.
③根据一氧化碳的性质来分析;
④可燃性气体或粉尘与氧气混合达到一定程度时,遇明火会发生爆炸;
⑤氢氧化钠溶液能够吸收二氧化碳;氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水.
解答:解:①D中浓硫酸的作用是干燥气体,实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,氧化铜与气体反应后生成了二氧化碳,故通入的是一氧化碳,所以E中黑色粉末变红色,则可证明草酸亚铁晶体热分解的气体产物是H2O,CO,CO2.故填:黑色粉末变红色;H2O;CO2.
②设参加反应的氧化铜的质量为x,
则CO+CuO
CO2+Cu
80 64
x 6.4g
=
x=8g
则氧化铜的物质的量为
=0.1mol
答:参加反应的氧化铜的物质的量是0.1mol.
故答案为:0.1mol;CO+CuO
CO2+Cu;
③一氧化碳不能支持燃烧,但是具有可燃性,所以会看到木条熄灭,气体燃烧发出蓝色火焰,但是不纯会发生爆炸;故填:ACD;
④进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是:把装置中的空气排尽,避免一氧化碳和空气混合达到爆炸极限时,加热时发生爆炸.
故填:把装置中的空气排尽,避免一氧化碳和空气混合达到爆炸极限时,加热时发生爆炸.
⑤氢氧化钠溶液能吸收二氧化碳,生成碳酸钠和水,澄清的石灰水用来检验二氧化碳是否被完全吸收,故填:CO2+2NaOH═Na2CO3+H2O;检验二氧化碳是否完全除净.
②设参加反应的氧化铜的质量为x,
则CO+CuO
| ||
80 64
x 6.4g
| 80 |
| 64 |
| x |
| 6.4g |
x=8g
则氧化铜的物质的量为
| 8g |
| 80g/mol |
答:参加反应的氧化铜的物质的量是0.1mol.
故答案为:0.1mol;CO+CuO
| ||
③一氧化碳不能支持燃烧,但是具有可燃性,所以会看到木条熄灭,气体燃烧发出蓝色火焰,但是不纯会发生爆炸;故填:ACD;
④进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是:把装置中的空气排尽,避免一氧化碳和空气混合达到爆炸极限时,加热时发生爆炸.
故填:把装置中的空气排尽,避免一氧化碳和空气混合达到爆炸极限时,加热时发生爆炸.
⑤氢氧化钠溶液能吸收二氧化碳,生成碳酸钠和水,澄清的石灰水用来检验二氧化碳是否被完全吸收,故填:CO2+2NaOH═Na2CO3+H2O;检验二氧化碳是否完全除净.
点评:本考点属于实验探究题,实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验现象和分析,得到了正确的结论,属于实验过程和结论的探究.同学们要具体分析,综合掌握.本题型主要出现在实验题中.

练习册系列答案
相关题目
维生素D是脂溶性维生素,具有抗佝偻病的作用.其中最重要的有两种:维生素D2(化学式为C28H44O)和维生素D3(化学式为C27H44O).下列有关说法中,正确的是( )
| A、维生素D2和维生素D3的分子不同 |
| B、维生素D2和维生素D3都是由C、H、O三种元素组成 |
| C、维生素D2分子是由维生素D3分子和一个碳原子构成的 |
| D、维生素D2和维生素D3中氢元素的质量分数相同 |
下列物质的应用正确的是( )
A、 不锈钢用于制炊具 |
B、 铁制作导线 |
C、 氧气用于医疗麻醉 |
D、 二氧化碳气体用于人工降雨 |
 甲、乙、丙、丁是初中化学中常见的不同物质,其中甲为黑色固体.其转化关系如图所示:
甲、乙、丙、丁是初中化学中常见的不同物质,其中甲为黑色固体.其转化关系如图所示: