题目内容
养成“规范操作、周密观察”的良好实验习惯,是完成化学实验的关键.
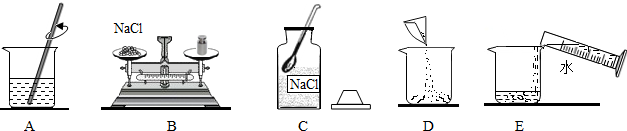
(1)如图是实验室配制50g10%的氯化钠溶液的操作示意图,正确操作顺序为 (填字母序号);
①某同学在配制过程中,量取水时俯视读数,所配制的氯化钠溶液的溶质质量分数将 (偏大或偏小)
②另一位同学若配制的是氢氧化钠溶液,由于操作不熟练,花了较长时间,那么,所配制的氢氧化钠溶液的溶质质量分数将 (偏大或偏小)
(2)为证明酸与碱能发生反应,某同学进行了以下实验,请看图回答: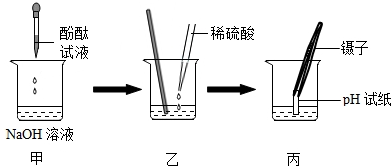
①图甲:滴入酚酞试液后,观察到的现象为 .
②乙:用滴管慢慢滴入稀硫酸,并不断搅拌至溶液颜色恰好变成 为止.
③图丙:丙中操作存在的问题是 ;若用正确操作测得丙中溶液的pH=5,溶液中溶质的化学式为 .
(1)如图是实验室配制50g10%的氯化钠溶液的操作示意图,正确操作顺序为

①某同学在配制过程中,量取水时俯视读数,所配制的氯化钠溶液的溶质质量分数将
②另一位同学若配制的是氢氧化钠溶液,由于操作不熟练,花了较长时间,那么,所配制的氢氧化钠溶液的溶质质量分数将
(2)为证明酸与碱能发生反应,某同学进行了以下实验,请看图回答:

①图甲:滴入酚酞试液后,观察到的现象为
②乙:用滴管慢慢滴入稀硫酸,并不断搅拌至溶液颜色恰好变成
③图丙:丙中操作存在的问题是
考点:一定溶质质量分数的溶液的配制,中和反应及其应用
专题:溶液、浊液与溶解度,常见的酸 酸的通性
分析:(1)观察操作图,分析每个操作的作用,根据配制溶液的步骤对操作进行排序;
①根据量取水时俯视读数,会使量取的水的体积偏小进行分析;
②根据氢氧化钠在空气中变质后质量增加进行分析;
(2)①根据酚酞遇氢氧化钠变红色进行分析;
②根据酸碱中和反应的实质进行;
③根据溶液的酸碱性确定溶质的成分,和PH试纸的使用注意事项进行分析.
①根据量取水时俯视读数,会使量取的水的体积偏小进行分析;
②根据氢氧化钠在空气中变质后质量增加进行分析;
(2)①根据酚酞遇氢氧化钠变红色进行分析;
②根据酸碱中和反应的实质进行;
③根据溶液的酸碱性确定溶质的成分,和PH试纸的使用注意事项进行分析.
解答:解:(1)图A是搅拌溶解,图B为称取氯化钠的操作,图C为用药匙取出固体氯化钠准备进行称量,图D为把称量的氯化钠倒入烧杯,图E为量取一定量的水倒入烧杯,所以正确的操作顺序为:CBDEA;
①量取水时俯视读数,会使量取的水的体积偏小,所以配制的氯化钠溶液的溶质质量分数将偏大;
②氢氧化钠在空气中变质后质量增加,氢氧化钠少了,所以配制的氢氧化钠溶液的溶质质量分数将偏小;
(2)①氢氧化钠溶液中滴入酚酞试液后变红色;
②稀硫酸与氢氧化钠发生酸碱中和反应,会使溶液碱性消失,溶液会有红色变为无色;
③用PH试纸测定溶液的PH时,试纸不能浸入了溶液中,会把溶液污染;测得丙中溶液的pH=5,说明溶液显酸性,及硫酸有剩余,所以溶液中溶质有过剩的硫酸,以及生成的硫酸钠两种物质.
答案:(1)CBDEA;
①偏大;
②偏小;
(2)①溶液变红色;
②无色;
③PH试纸浸入了溶液中,H2SO4,Na2SO4.
①量取水时俯视读数,会使量取的水的体积偏小,所以配制的氯化钠溶液的溶质质量分数将偏大;
②氢氧化钠在空气中变质后质量增加,氢氧化钠少了,所以配制的氢氧化钠溶液的溶质质量分数将偏小;
(2)①氢氧化钠溶液中滴入酚酞试液后变红色;
②稀硫酸与氢氧化钠发生酸碱中和反应,会使溶液碱性消失,溶液会有红色变为无色;
③用PH试纸测定溶液的PH时,试纸不能浸入了溶液中,会把溶液污染;测得丙中溶液的pH=5,说明溶液显酸性,及硫酸有剩余,所以溶液中溶质有过剩的硫酸,以及生成的硫酸钠两种物质.
答案:(1)CBDEA;
①偏大;
②偏小;
(2)①溶液变红色;
②无色;
③PH试纸浸入了溶液中,H2SO4,Na2SO4.
点评:配制溶液时,先称取固体药品倒入烧杯,然后再量取水倒入烧杯,最后进行搅拌溶解.

练习册系列答案
相关题目
根据如图有关信息判断,下列说法错误的是( )


| A、镁离子(Mg2+)核内有12个质子 |
| B、镁的相对原子质量为24.31 |
| C、在化学反应中,硫原子容易得到2个电子 |
| D、镁与硫都是金属元素 |
下列物质所表现出来的性质属于化学性质的是( )
| A、食盐能溶于水,具有咸味 |
| B、二氧化碳气体能使澄清石灰水变浑浊 |
| C、铜能够导电 |
| D、铜质门把手上产生绿色斑点 |