题目内容
14. 为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:| 第I组 | 第Ⅱ组 | 第Ⅲ组 | |
| 稀硫酸的质量/g | 50 | 100 | 150 |
| 溶解固体的质量/g | 10.0 | 16.0 | 16.0 |
(1)第I组实验中反应物稀硫酸(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完.
(2)20g样品中含氧化铜的质量为16g.
(3)根捃第Ⅰ组数据计算所用的稀硫酸溶质的质量分数(写出计算过程)
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图.
分析 (1)样品中的氧化铜和硫酸反应而铜不和硫酸反应,
(2)样品中的氧化铜和硫酸反应而铜不和硫酸反应,第一组实验50g稀硫酸溶解掉固体的质量是10.0g,第二组实验是100g稀硫酸溶解掉固体的质量是16.0g,由此得出结论,第一组实验酸不足,第二组实验酸剩余氧化铜完全反应掉,从而可求出20g样品中含氧化铜的质量,利用质量分数的公式求出样品中氧化铜的质量分数.
(3)由上分析第一组实验酸完全反应,因此可利用第一组实验中的数据和CuO+H2SO4═CuSO4+H2O 求出所用的稀硫酸溶质的质量分数.
(4)由上分析第二组实验中酸有剩余,当往溶液中滴加氢氧化钠溶液时,我们可看成氢氧化钠溶液先和酸反应再和硫酸铜反应.利用第二组实验中的数据和CuO+H2SO4═CuSO4+H2O 计算出剩余的稀硫酸的质量,从而得到起点坐标,然后再利用CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 求出和硫酸铜反应的氢氧化钠溶液的质量以及生成的沉淀的质量从而得到折点坐标.
解答 解:(1)样品中的氧化铜和硫酸反应而铜不和硫酸反应,第I组实验中反应物是稀硫酸反应完;故填:稀硫酸;
(2)20g样品中含氧化铜的质量16g,故填:16.
样品中氧化铜的质量分数:$\frac{16g}{20g}$×100%=80%,故填80%.
(3)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
80 98
10g 50g•x
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(4)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO+H2SO4═CuSO4+H2O
80 98 160
16g 24.5%y z
$\frac{80}{16g}=\frac{98}{24.5%y}=\frac{160}{z}$
解得 y=80g
解得 z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4+2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
$\frac{98}{(100g-80g)×24.5%}=\frac{80}{10%m}$
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98
32g 10%n w
$\frac{160}{32g}=\frac{80}{10%n}=\frac{98}{w}$
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如图.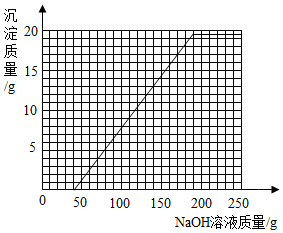
点评 本题利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力以及绘制图象的能力.

| A. | 一氧化碳 | B. | 烟尘 | C. | 二氧化碳 | D. | 二氧化硫 |
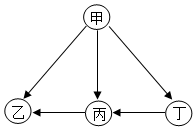 现有甲、乙、丙、丁四种金属,采用将其中的一种金属分别放入另外三种金属的硝酸盐溶液中的方法进行实验,得到四种金属间的转化关系(如图所示).则四种金属的活动性由强到弱的顺序是( )
现有甲、乙、丙、丁四种金属,采用将其中的一种金属分别放入另外三种金属的硝酸盐溶液中的方法进行实验,得到四种金属间的转化关系(如图所示).则四种金属的活动性由强到弱的顺序是( )| A. | 甲、乙、丙、丁 | B. | 甲、丁、丙、乙 | C. | 乙、丙、丁、甲 | D. | 丁、丙、乙、甲 |

(1)物质的三态变化,主要是由于D.
A、微粒大小发生变化B、微粒质量发生变化C、变成了新微粒D、微粒间的间隔发生改变
(2)醋酸(CH3COOH)是一种常见的酸,具有酸的通性例如:醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为:CH3COOH+NaOH=CH3COONa+H2O.写出该反应的微观实质H++OH-=H2O,醋酸与盐酸一样,能与活泼金属反应生成氢气,请写出醋酸与金属锌反应的化学方程式2CH3COOH+Zn=(CH3COO)2Zn+H2↑.
(3)物质组成和结构决定其性质,性质决定其用途.过氧化氢是一种常见杀菌消毒剂,其原因是过氧化氢分子中含有一种叫做“过氧基’,(如图中虚线框标出的部分)的结构.据此推测如图1②-④的物质中,可用作杀菌消毒剂的是④(填序号)
(4)胃酸过多须服用抗酸药.如表为两种抗酸药的有效成分及其构成微粒:
| 抗胃酸药 | 复方氢氧化镁片 | 铝碳酸镁片 |
| 有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
(5)一定条件下,甲和乙反应生成丙和丁(四 种物质均由分子构成),反应前后微观示意图如图2.下列说法正确的是BD(填选项)
A、反应前后共有4种原子
B、该反应有单质生成
C、反应前后元素化合价都不变
D、化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2:3.
| A. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| B. | 因为酚酞试液遇碱变红色,所以能使酚酞变红色的一定是碱 | |
| C. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成中一定含有C、H和O | |
| D. | 有化合价升降的反应是氧化还原反应,所以复分解反应一定不是氧化还原反应 |
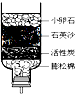 水是生命之源,生活中净化水的方法很多.
水是生命之源,生活中净化水的方法很多.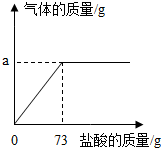 为了分析生铁中铁的含量,某学习小组进行了实验研究:取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见图).(说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应)
为了分析生铁中铁的含量,某学习小组进行了实验研究:取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见图).(说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应)