题目内容
12.将6.8g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6g,试计算:(1)生成氢气的质量.
(2)锌粒中所含锌的质量分数(精确到0.1%).
(3)求稀硫酸的溶质质量分数
(4)反应后所得溶液的溶质质量分数.
分析 根据反应前后的质量差可以计算生成氢气的质量,根据氢气的质量可以计算锌、硫酸锌的质量,进一步可以计算锌粒中所含锌的质量分数、所得溶液的质量分数.
解答 解:(1)根据质量守恒定律,生成氢气的质量为:6.8g+50.0g-56.6g=0.2g,
答:生成了0.2g氢气.
(2)解:设锌粒中含锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x y z 0.2g
则$\frac{65}{x}=\frac{98}{y}=\frac{161}{z}=\frac{2}{0.2g}$,解得x=6.5g,y=9.8g,z=16.1g,
锌粒中锌的质量分数为:$\frac{6.5g}{6.8g}×100%=95.6%$,
答:锌粒中所含锌的质量分数为95.6%.
(3)硫酸溶液里溶质的质量分数是$\frac{9.8g}{50g}×100%$=19.6%
(4)溶液的质量为:6.5g+50.0g-0.2g=56.3g,
所得溶液的质量分数为:$\frac{16.1g}{56.3g}$×100%=28.6%,
故答案为:
(1)0.2g.(2)95.6%.(3)19.6%;(4)28.6%,
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
3.下列做法科学的是( )
| A. | 用盐酸可以去除生石灰中的少量CaCO3 | |
| B. | 用燃烧法可以区别涤纶和羊毛 | |
| C. | 用稀硫酸可以除去铁粉中混有的少量氧化铜 | |
| D. | 用Ba(NO3)2溶液可以除去稀盐酸中少量的H2SO4 |
20.化学是一门以实验为基础的科学,许多化学重大发现和研究成果都是通过实验得到的.下列实验操作或设计中正确的是( )
| A. |  用100mL量筒量取8.5mL盐酸 用100mL量筒量取8.5mL盐酸 | B. |  收集氢气 收集氢气 | ||
| C. |  验证质量守恒定律 验证质量守恒定律 | D. |  分离碘酒中的碘 分离碘酒中的碘 |
17.除去氯化钾溶液中混有少量的K2CO3,以得到较纯净的KCl溶液,可加入适量的 ( )
| A. | 盐酸 | B. | AgNO3溶液 | C. | CaCl2溶液 | D. | Ba(NO3)2溶液 |
1.四氟乙烯(C2F4)中氟元素的化合价是-1价,则碳元素的化合价与下列哪种物质中碳元素的化合价相同( )
| A. | C | B. | CH4 | C. | CO | D. | CO2 |
18.许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:硫在纯氧中燃烧比在空气中进行得更快,更剧烈.答:增大反应物浓度,可以加快化学反应速率.
(1)同种食品在夏天比冬天更容易变质.答:升高温度,可以加快化学反应速率
(2)过氧化氢溶液在常温下能缓慢分解,若加入少量二氧化锰时分解加速.
答:使用催化剂,可以加快化学反应速率
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完.
答:增大反应物的接触面积,可以加快化学反应速率
(4)以下是某研究小组探究影响反应速率部分因素的相关实验数据.
①通过实验①和②对比可知,化学反应速率与反应物浓度有关;从实验③和④对比可知,化学反应速率与温度的关系是温度越高,反应速率越快;
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量不变(选填“减小”或“不变”或“增大”).
(1)同种食品在夏天比冬天更容易变质.答:升高温度,可以加快化学反应速率
(2)过氧化氢溶液在常温下能缓慢分解,若加入少量二氧化锰时分解加速.
答:使用催化剂,可以加快化学反应速率
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完.
答:增大反应物的接触面积,可以加快化学反应速率
(4)以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 | 过氧化氢溶 液浓度/% | 过氧化氢溶液体积/mL | 温度/℃ | 二氧化锰用量/g | 收集氧气体积/mL | 反应所需 时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 |  | 2 | 49.21 |
| ④ | 30 | 5 | 55 |  | 2 | 10.76 |
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量不变(选填“减小”或“不变”或“增大”).

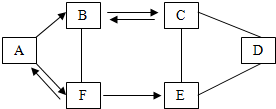 A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质,(部分反应物,生成物及反应条件已略去)请回答:
A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质,(部分反应物,生成物及反应条件已略去)请回答: