题目内容
20.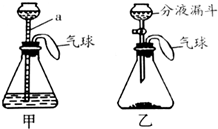 某化学兴趣小组设计了一组“吹气球”实验,两套装置如图所示:
某化学兴趣小组设计了一组“吹气球”实验,两套装置如图所示:(1)向甲装置的a中加水会看到气球胀大,一段时间内气球大小没有变化,此现象说明装置气密性良好,请分析气球胀大的原因加入的水占据了锥形瓶内的空间,使锥形瓶中压强增大,气球膨胀;
(2)若乙装置锥形瓶中的固体为NaOH,分液漏斗中的液体为水,则使气球胀大的主要原因是氢氧化钠固体溶于水放热,锥形瓶内空气受热膨胀,使气球胀大;
(3)若乙装置中固体与液体反应生成O2使气球胀大,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
分析 (1)向a中加水会看到气球胀大,一段时间内气球大小没有变化,说明该装置气密性良好;因为加入的水占据了锥形瓶内的空间,使锥形瓶中压强增大,气球膨胀;
(2)氢氧化钠溶于水放出大量的热;
(3)过氧化氢在二氧化锰的催化作用下能反应生成水和氧气,使气球胀大.
解答 解:(1)向a中加水会看到气球胀大,一段时间内气球大小没有变化,说明该装置气密性良好;因为加入的水占据了锥形瓶内的空间,使锥形瓶中压强增大,气球膨胀;
(2)氢氧化钠固体溶于水放热,锥形瓶内空气受热膨胀,使气球胀大;
(3)过氧化氢在二氧化锰的催化作用下能反应生成水和氧气,使气球胀大,化学方程式为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故答案为:(1)加入的水占据了锥形瓶内的空间,使锥形瓶中压强增大,气球膨胀;
(2)氢氧化钠固体溶于水放热,锥形瓶内空气受热膨胀,使气球胀大;
(3)2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
点评 此题的难度不大,掌握实验室制取氧气的原理以及氢氧化钠的性质等即可顺利解答此题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.对于K和K+的说法,正确的是( )
| A. | 具有相同的电子层数 | B. | 属于同一种粒子 | ||
| C. | 核外电子数相同 | D. | 属于同一种元素 |

 向一定量的稀盐酸中逐渐加入某种不纯的铁粉,加入铁粉的量与生成H2的关系如图所示,请回答有关问题:
向一定量的稀盐酸中逐渐加入某种不纯的铁粉,加入铁粉的量与生成H2的关系如图所示,请回答有关问题: 如图表示某些物质间转化关系.A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味.
如图表示某些物质间转化关系.A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味.
