题目内容
19. “防治碘缺乏病日”的主题是“坚持食用碘盐,预防出生缺陷”.据了解,有些偏远地区不少人受到碘缺乏病威胁,这是源于碘盐每500克售价1.2元,不加碘的私盐往往0.5元就卖.巨大的利润驱使不法分子走街串巷,将这些非碘盐直销到偏远地区、农村.
“防治碘缺乏病日”的主题是“坚持食用碘盐,预防出生缺陷”.据了解,有些偏远地区不少人受到碘缺乏病威胁,这是源于碘盐每500克售价1.2元,不加碘的私盐往往0.5元就卖.巨大的利润驱使不法分子走街串巷,将这些非碘盐直销到偏远地区、农村.(1)资料表明:炒菜爆锅时加碘盐,利用率为10%;中间时间放碘盐,利用率为60%;出锅时放碘盐,利用率是90%;拌凉菜时放碘,利用率是100%.据此,请你在加碘盐包装袋上“食用方法”一栏里拟定应出示的文字(控制在15字内)在炒菜时,等到菜快熟了再加碘盐.
(2)一种测定含碘量的化学原理是:KIO3+5KI+3H2SO4=2K2SO4+3I2+2H2O,I2+2Na2S2O3=2NaI+Na2S4O8,从碘元素考虑,这两个化学方程式共同的特点是碘元素的化合价都发生了变化,请你根据你的理解,将“氧化还原反应”用画图画在如图合适的位置.
分析 (1)根据,确定出放盐的最好时机;(2)通过计算发现碘元素的化合价发生了变化;只要有元素化合价发生改变的反应,属于氧化还原反应.
解答 解:(1)炒菜爆锅时加碘盐,利用率为10%;中间时间放碘盐,利用率为60%;出锅时放碘盐,利用率是90%;拌凉菜时放碘,利用率是100%,所以在加碘盐包装袋上“食用方法”一栏里拟定应出示的文字是:在炒菜时,等到菜快熟了再加碘盐;
(2)通过这两个方程式:KIO3+5KI+3H2SO4=2K2SO4+3I2+2H2O,I2+2Na2S2O3=2NaI+Na2S4O8发现,碘元素的化合价都发生了变化;置换反应的化合价一定发生变化,一定属于氧化还原反应,化合反应的元素化合价可能变,可能不变,分解反应的元素化合价可能变,可能不变,复分解反应的元素化合价一定不变,一定不属于氧化还原反应.
故答案为:(1)在炒菜时,等到菜快熟了再加碘盐;(2)碘元素的化合价都发生了变化;
点评 解答本题关键是知道从题干中如何提取有用信息,并能灵活运用.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
9.下列变化中,分子均匀分散另一分子中的是( )
| A. |  | B. |  | C. |  | D. |  |
7. 锌是人体中必需的微量元素,锌元素的部分信息如图,则下列说法正确的是( )
锌是人体中必需的微量元素,锌元素的部分信息如图,则下列说法正确的是( )
 锌是人体中必需的微量元素,锌元素的部分信息如图,则下列说法正确的是( )
锌是人体中必需的微量元素,锌元素的部分信息如图,则下列说法正确的是( )| A. | 锌的相对原子质量为65.38g | B. | 锌原子核外电子数为30 | ||
| C. | 锌原子结构示意图中X为8 | D. | 锌原子在反应中容易得到电子 |
14.金属材料在生产、生活中科学研究中应用广泛.
(1)如表示A、B、C三种金属的部分物理性质
①三种金属中最不适宜作导线的是C(填字母),高压电线不用金属A而选用B,主要原因是高压线一般需要较大的横截面,且为高空架设,故宜选用密度小、导电性能较好的金属.
②C的合金通常可以做菜刀、锤子等,是因为其合金的硬度较纯C大(填“大”或“小”).
(2)某化学小组以某工业废水水样为研究对象,在实验室中完成以下实验.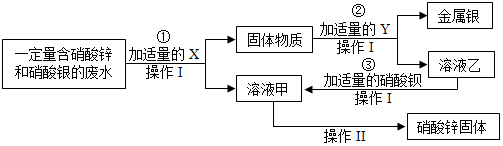
①该小组的实验目的是从工业废水中回收金属银和硝酸锌固体.
②物质x是锌;溶液乙中溶质是硫酸锌;反应③的基本反应类型是复分解反应.
③操作Ⅰ和操作Ⅱ中都要用到一种或几种玻璃仪器,该仪器在操作Ⅱ中的作用是搅拌、防止因局部温度过高造成液滴飞溅.
(1)如表示A、B、C三种金属的部分物理性质
| 金属 | 导电性(100为标准) | 密度(g/cm3) | 熔点(℃) |
| A | 99 | 8.92 | 1083 |
| B | 61 | 2.70 | 660 |
| C | 17 | 7.86 | 1535 |
②C的合金通常可以做菜刀、锤子等,是因为其合金的硬度较纯C大(填“大”或“小”).
(2)某化学小组以某工业废水水样为研究对象,在实验室中完成以下实验.

①该小组的实验目的是从工业废水中回收金属银和硝酸锌固体.
②物质x是锌;溶液乙中溶质是硫酸锌;反应③的基本反应类型是复分解反应.
③操作Ⅰ和操作Ⅱ中都要用到一种或几种玻璃仪器,该仪器在操作Ⅱ中的作用是搅拌、防止因局部温度过高造成液滴飞溅.
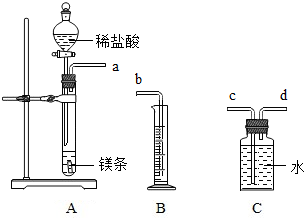 一定质量的镁与足量盐酸反应,用排水法测量产生氢气的体积,查密度表求出氢气的质量,再根据化学方程式计算出镁的相对原子质量.请利用如图给定仪器组装一套测定镁的相对原子质量的实验装置(每种仪器只用一次),并回答相关问题.
一定质量的镁与足量盐酸反应,用排水法测量产生氢气的体积,查密度表求出氢气的质量,再根据化学方程式计算出镁的相对原子质量.请利用如图给定仪器组装一套测定镁的相对原子质量的实验装置(每种仪器只用一次),并回答相关问题.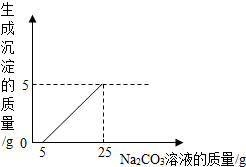 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示. 小华同学做铁丝在氧气中燃烧的实验时,用了两种不同的方法点燃铁丝.请分析回答:
小华同学做铁丝在氧气中燃烧的实验时,用了两种不同的方法点燃铁丝.请分析回答: